均无明显现象(无气泡)
(1)写出以上反应的离子方程式______________________________________??。
(2)分析上表数据,你得出的结论是:??????????????????????????????????。
(3)你认为出现以上现象的可能原因是(写出一个即可):
__________________________________??????___________________?_;
(4)请设计实验对你的假设进行验证:
_______________________________________________????___________;
(5)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有(列举三个):????????????????????????????????????????????????????
参考答案:(1)2Al+6H+==2Al3++3H2↑(2′)
本题解析:(1)金属绿意稀硫酸或盐酸反应放出氢气,反应的离子方程式是
2Al+6H+==2Al3++3H2↑。
(2)根据反应的剧烈程度及生成的气泡多少可知,其结论应该是Al在c(H+)相同的盐酸中反应比在硫酸中快得多。
(3)根据题意,两种溶液中不同的是酸根离子,所以可能的原因是①Cl-对铝与H+反应有促进作用;②SO42-对铝与H+反应有抑制作用。
(4)如果验证以上的假设,则可以通过对照实验进行对比,即①向以上稀硫酸中加入少量的氯化钠或氯化钾(或其他可溶性氯化物)固体,如果都能使反应速
本题难度:一般
2、选择题 在N2+3H2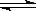 2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( ) 2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
A.0.2mol/L·S
B.0.4mol/L·S
C.0.6mol/L·S
D.0.8mol/L·S
参考答案:A
本题解析:
试题分析:根据N2+3H2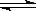 2NH3,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,所以v(N2)=0.4/2=0.2mol/L·S???,故本题的答案选择A。 2NH3,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,所以v(N2)=0.4/2=0.2mol/L·S???,故本题的答案选择A。
点评:本题考查化学反应速率的计算,属于对基础知识的考查,本题比较简单。
本题难度:一般
3、选择题 设C + CO2 2CO 2CO  的反应速率为 的反应速率为 ,N2 + 3H2 ,N2 + 3H2 2NH3 2NH3
参考答案:
本题解析:
本题难度:简单
4、填空题 (6分)在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如右图所示
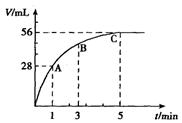
(1)该反应的化学方程式为??????????????。?????????????????????????????????????
(2)若溶液的体积保持50mL不变,则在前五分钟H2O2的平均反应速率为?????????mol/(L·min)。
(3)试解释A、B、C各点所表示的反应速率变化的原因??????????????????????
参考答案:(1)2H2O2="====" 2H2O+O2↑(2)0.0
本题解析:略
本题难度:简单
5、填空题 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
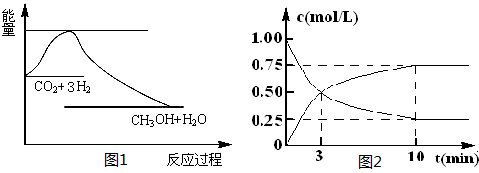
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
参考答案:(17分) (1)C(2分)(2) ① 0.075 mol·
本题解析:
试题分析:(1)根据图1可知,该反应的反应物总能量高于生成物总能量,所以反应是放热反应,即△H<0;根据方程式可知,该反应是气体体积减小的可逆反应,因此△S<0,答案选C。
(2)①根据图2可知,反应进行到10min时,各种物质的浓度不再发生变化,反应达到平衡状态。根据图2可知,甲醇的浓度增加了0.75mol/L,所以甲醇的反应速率v(CH3OH)=0.75mol/L÷10min=0.075 mol·L-1·min-1;根据方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,所以氢气的转化率是w(H2)=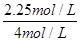 ×100%=56.25%。 ×100%=56.25%。
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式K=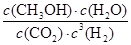 。 。
③依据化学反应的影响因素和条件逐项分析判断即可:A、反应是放热反应,升高温度平衡逆向进行;B、将CH3OH(g)及时液化抽出,减小生成物的浓度平衡正向进行;C、选择高效催化剂只能改变反应速率,不能改变化学平衡;D、再充入l molCO2和4molH2,相当于增大压强平衡正向进行;答案选BD。
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,所以1mol甲醇即32g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ×2=726.6 kJ的热量,因此该反应的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1。
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。据此可知,该原电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;正极通入的是氧气,则正极电极反应式为O2+2H2O+4e-=4OH?。
考点:考查焓变和熵变、反应速率和转化率的计算、化学平衡常数、外界条件对平衡状态的影响、热化学方程式的书写以及燃料电池的有关判断和电极反应式的书写等
本题难度:一般
|