微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在体积可变的密闭容器中,反应mA(g)+nB(s)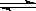 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
A.(m+n)必定小于p
B.(m+n)必定大于p
C.m必定小于p
D.n必定大于p
参考答案:C
本题解析:略
本题难度:一般
2、选择题 通常情况下氧气的密度是1.28 g/L,在实验室中利用KClO3制氧气,生成氧气的平均速率为0. 01
mol/(L·min),现要制取500 mL氧气,需要的时间为[???? ]
A.1 min
B.2 min
C.3 min
D.4 min
参考答案:D
本题解析:
本题难度:简单
3、计算题 (9分)在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
参考答案:(1) 本题解析:2H2(g) +CO(g)
本题解析:2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
n0????? 5????? 2????????? 0
△n???? 2x????? x????????? x
n(平衡)? 5-2x??? 2-x???????? x
利用PV=nRT,在恒温、恒容下,则n0/ n(平衡)=P0/P(平衡),
(5+2)/[(5-2x)+(2-x)+x]= P0/[4/7 P0],得:x=1.5 mol
(1)υ(H2)=(2x/0.5L)/5min=1.2 mol/(L·min)
(2)CO的转化率=x/2=75%
K=3/(42×1)=0.1875(mol/(L)-2
本题难度:一般
4、选择题 在一定温度下,反应H2(g)+ Br2(g) 2HBr(g),达到平衡的标志是
2HBr(g),达到平衡的标志是
A.容器里的压强不随时间的变化而改变
B.单位时间内生成2mol HBr的同时,消耗1 mol H2
C.单位时间内生成2mol HBr的同时,生成1 mol H2
D.正反应和逆反应速率都相等,都等于0
参考答案:C
本题解析:可逆达平衡的标志为:各组分的浓度保持不变、正逆反应速率相等;
A错,该反应为等体积反应,无论是否平衡压强均不变;B错,无论是否平衡都有单位时间内生成2mol HBr的同时,消耗1 mol H2;C正确,单位时间内生成2mol HBr的同时,生成1 mol H2,相当于各组分的浓度不变,即达平衡;D错,平衡时正、逆反应速率相等,但不等于0。
本题难度:简单
5、选择题 在一密闭恒容容器中发生如下反应:aX(g)+bY(g)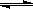 cZ(g)?ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g)?ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大
B.若通入稀有气体平衡不移动,则a+b=c
C.若加入催化剂,反应速率改变,但平衡不移动
D.若增加X的量,平衡正向移动,X的转化率增大
参考答案:C
本题解析:
试题分析:A、升高温度正逆反应速率同时增大,错误;B、定温定容的条件下充“惰气”对化学平衡无影响,相当于什么也没做,不能据此判断a、b、c的关系,错误;C、正确;D、增加一种反应物的浓度可以提高另一反应物的转化率,而其自身的转化率降低,错误。
本题难度:一般