微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:2SO2(g)+O2(g) 2SO3(g)??????ΔH=-196.0kJ·mol-1
2SO3(g)??????ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g)??????ΔH="-113.0" kJ·mol-1
2NO2(g)??????ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g)???????????????ΔH=" 20.0" kJ·mol-1
2SO3(g)???????????????ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式??????????????????????;???
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是?????????。
a.体系压强保持不变??
b.混合气体颜色保持不变??
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为?????????。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率?????(变大、变小或不变)。
参考答案:SO2(g)+NO2(g) 本题解析:考查盖斯定律的应用。由反应①2SO2(g)+O2(g)
本题解析:考查盖斯定律的应用。由反应①2SO2(g)+O2(g) 2SO3(g)? ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g)
2SO3(g)? ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l)
2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l) 2SO3(g)??????????????? ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g)
2SO3(g)??????????????? ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g) 2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
①因为反应前后体积是变化的,所以当压强不再变化时,可以说明已经达到平衡。颜色的深浅与其浓度大小有关,所以当颜色不再变化时,也可以说明已经达到平衡状态。三氧化硫是液体,C不正确。消耗消耗1 mol SO3的同时必然生成1 molNO2 m,不能说明。
②?????????????????????????? SO2(g)+NO2(g) SO3(l)+NO(g)
SO3(l)+NO(g)
起始量(mol)???????????????2???????? 1??????????? 0??????? 0
转化量(mol)??????????????? 0.5?????? 0.5?????????? 0.5????? 0.5
平衡量(mol)??????????????? 1.5?????? 0.5?????????? 0.5????? 0.5
反应前后容器内压强比为 .
.
③恒压密闭容器中发生上述反应时,若加入Ar气,则容器的体积必然增大,即物质的浓度会减小,反应速率则降低。
本题难度:一般
2、选择题 对于可逆反应4NH3(g)+5O2(g)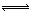 4NO(g)+6H2O(g)下列叙述正确的是(?)。
4NO(g)+6H2O(g)下列叙述正确的是(?)。
A.达到平衡时:4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态。
C.达到平衡时,若增加容器容积,则正反应速率减小,逆反应速率增大
D.化学反应的速率关系是:2v正(NH3)=3v逆(H2O)
参考答案:A
本题解析:A正确;B错,每时每刻均这样反应;C错,达到平衡时,若增加容器容积,反应物与生成物的浓度均减小,则正反应速率减小,逆反应速率减小;D错,化学反应的速率关系是:3v正(NH3)=2v逆(H2O)
本题难度:一般
3、选择题 在一定条件下,将1molN2和3molH2混合,发生反应N2(g)+3H2(g) 2NH3(g),平衡后测得混合气体的密度是相同条件下氢气密度的5倍,则N2的转化率为[???? ]
2NH3(g),平衡后测得混合气体的密度是相同条件下氢气密度的5倍,则N2的转化率为[???? ]
A.10%
B.30%
C.50%
D.60%
参考答案:B
本题解析:
本题难度:一般
4、选择题 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是(???? )
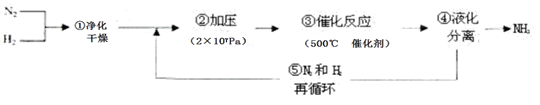
A.①②③
B.②④⑤
C.①③⑤
D.②③④
参考答案:B
本题解析:合成氨气的反应是体积减小的、放热的可逆反应。所以增大压强平衡向正反应方向移动,可提高原料的转化率,催化剂不能影响平衡状态,不能提高转化率。把生成物氨气及时分离出来,可以促使平衡向正反应方向移动,提高转化率。通过氮气和氢气的循环使用,可以越高原料的利用率,所以正确的答案是B。
本题难度:一般
5、选择题 某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g) 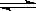 2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
A.20%
B.40%
C.60%
D.80%
参考答案:A
本题解析:2M(g)+N(g) 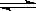 2E(g)
2E(g)
起始物质的量 0????? 0????????? 2
转化物质的量 2x???? x????????? 2x
平衡物质的量2x????? x???????? 2-2x
达平衡时,E的转化率为40%,2x/2=40%?? x=0.4
若开始时充入2 mol M和1 mol N,达平衡时和第一次是全等等效平衡,平衡时M、N、E的物质的量分别为0.8mol、0.4mol、1.2mol,平衡时总物质的量为2.4mol,混合前是3mol,达平衡时混合气体的压强比起始时减少了(3-2.4)/3=20% ,故选A
本题难度:简单