微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 右图装置可用于?????
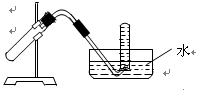
A.加热NaHCO3固体制CO2
B.Cu和稀HNO3反应制NO
C.NH4Cl与浓Ca(OH)2溶液反应制NH3
D.Cu和浓HNO3反应制NO2
参考答案:B
本题解析:装置中看出为固液和液液反应,排水法收集;A、固体加热,试管向下倾斜;B、可以;C、氨气不能使用排水法;D、二氧化氮不能使用排水法。
本题难度:简单
2、实验题 (14分)海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)请列举海水淡化的一种方法__________________________。
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br—,其目的是_____________________
___________________________________________________________________________。
(4)写出步骤II反应的离子方程式__________________________________________。
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。
(6)将MgCl2·6H2O直接加热能否得到MgCl2固体?_________。用化学方程式解释出原因_______________________________________________________________________。
参考答案:(14分,除注明外,其余每空2分)
(1)蒸馏法(或电
本题解析:考查海水资源的利用、物质的分离及提纯
(1)例如冷冻法、蒸馏法、电渗析法、离子交换法等
(2)萃取剂的选择标准,一是溴在其中的溶解度大,二是与原溶剂不能互溶,例如CCl4等,萃取时主要用到的是分液漏斗
(3)虽然溴元素在海水中的总含量较大,但其浓度较小,所以需要进行溴元素的富集
(4)两者发生氧化还原反应:Br2+SO2+2H2O=4H++SO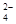 +2Br—
+2Br—
(5)由于Mg(OH)2的溶解度小于Ca(OH)2,可用MgCl2溶液来洗涤, 破坏Ca(OH)2的溶解平衡,得到Mg(OH)2
(6)MgCl2为强酸弱碱盐,可水解,如果直接加热其晶体,促进其水解,并不能得到MgCl2固体,故一般在酸性氛围中加热脱水,以抑制其水解
本题难度:一般
3、实验题 ?呋喃甲醇和呋喃甲酸是有机合成中的常用试剂,可用呋喃甲醛制备,其实验原理为:
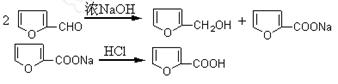
制备方法如下:①在50mL烧杯中放置3.28mL(0.04mol)呋喃甲醛,并用冰水冷却;称取1.6gNaOH溶于少量水中,在搅拌下滴加氢氧化钠水溶液于呋喃甲醛中。②在8~12℃下连续搅拌40min。③向反应混合物加入适量水使其恰好完全溶解,用乙醚萃取分液。④乙醚萃取物用无水硫酸镁干燥后,先在水浴中蒸去乙醚,然后蒸馏,收集169~172℃馏分得1.4g产品。⑤在乙醚提取后的水溶液中慢慢滴加浓盐酸到pH=3,搅拌,冷却,结晶,抽滤。⑥产物用少量冷水洗涤,抽干后,收集粗产物。再提纯后得精产品1.5g。
(1)本实验中,氢氧化钠必须溶于少量的水,否则水量过大主要会影响__________收率。
(2)本实验中要充分连续搅拌40min,其目的是______________________________。
(3)萃取时,用到的主要硅酸盐质的仪器是__________;抽滤的优点是______________________________________________________________________。
(4)呋喃甲酸粗产品提纯的方法是________________________________________。
(5)本实验中呋喃甲酸的产率为________________________________________ 。
参考答案:(1)呋喃甲酸
(2)这是在两相中进行的反应,长时间充
本题解析:
(1)呋喃甲酸
(2)这是在两相中进行的反应,长时间充分搅拌使其充分接触,保证反应完全。
(3)分液漏斗;过滤和洗涤速度加快,母液和晶体分离较完全,且产品易干燥。
(4)重结晶?
(5)理论上应得到0.02mol呋喃甲酸,所以,呋喃甲酸的产率为:1.5g/(0.02mol×112g/mol)×100%=67%
本题难度:一般
4、实验题 下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置图。
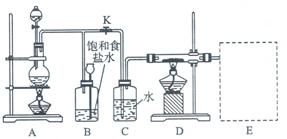
(1)A是氯气发生装置,其中发生反应的离子方程式为 ????????????????????????。
(2)实验开始时,先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为???????????????????????????????,装置C的作用是???????????????
(3) 该装置图尚未画完,请在E处补充完整,并注明试剂名称。
(4)D处反应完结后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是????????。
参考答案:(1) MnO2+4H++2Cl- 本题解析:
本题解析:
试题分析:(1) MnO2+4H++2Cl- ?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O
?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O  ?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
(4)B的作用是储存氯气
点评:氯气的制取实验是历年高考的重点和难点,本题在旧的知识上有新的拓展,注意氯气的制备装置,即可找到突破口。
本题难度:一般
5、选择题 下图是实验室制备CO2的简易装置图。用该装置制备CO2可起到随时使反应发生或停止的效果。选项中装置可起到与右图装置相同效果的是( )

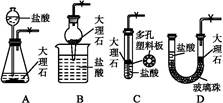
参考答案:B
本题解析:A装置如果关闭活塞,继续反应产生的CO2可以把液体压入长颈漏斗,但锥形瓶中剩余的液体继续与大理石反应,错误;B装置中的干燥管可以随时提起,正确;C装置为密闭体系、不能排开液体,错误;D装置,如果关闭活塞,继续反应产生的CO2,无法将右侧液体压下,因为左侧与大气不通,错误
本题难度:一般