?0.40
?
根据表中数据回答:
(1)压强从2×105Pa增加到4×105Pa时,平衡向??????反应方向移动(填“正”、“逆”)。
(2)压强从4×105Pa增加到8×105Pa时,平衡向?????反应方向移动(填“正”、“逆”),
可能原因是?????????????????????????????????。
(3)在10℃和2×105Pa的条件下,能作为该反应达到化学平衡状态的依据是?????????。
a.容器中气体的密度不变 ??? b.混合气体中c(A)不变
c.v正(A)·b=v逆(B) ·a ??????? d.混合气体的平均相对分子量不变
参考答案:(1)正;(2)逆;B物质发生了液化;(3)abcd
本题解析:略
本题难度:一般
2、选择题 在一定温度下,将等物质的量的CO和水蒸气通人恒容密闭容器中,发生如下反应:
CO(g)+H2O(g)  ?CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是 ?CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是
A.正反应速率等于零
B.正反应速率大于逆反应速率
C.正反应速率等于逆反应速率
D.正反应速率小于逆反应速率
参考答案:C
本题解析:平衡状态是一个动态平衡,是指正反应速率和逆反应速率相等。
本题难度:简单
3、填空题 (6分)【Ⅰ】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 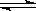 ?2C(g)+2D(g), ?2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为???????????????????;
(2)反应前A的物质的量浓度是???????????????;
【Ⅱ】某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 ?2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。 ?2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
参考答案:【Ⅰ】(1? 4mol·L-1·s-1(2分)(2)1.5
本题解析:【Ⅰ】3A(g) +B(g)  2C(g)+2D(g) 2C(g)+2D(g)
n始? xmol? xmol?????? 0????? 0
n变 1.2mol? 0.4mol?? 0.8mol?? 0.8mol
n末1.8mol? 0.6mol?? 0.8mol?? 0.8mol
x----1.2mol==1.8mol??? x===3.0mol??? Vc==0.8mol/2L×10s=4mol·L-1·s-1
CA==3.0mol/2L=1.5 mol·L-1
【Ⅱ】2 SO2+ O2 ?2 SO3 ?2 SO3
n始? 0.3mol? 0.2mol???? 0
n变2xmol?? xmol??????? 2xmol
n末o.3—2x?? 0.2-x ?????2x
n1=0.5mol??? n2=o.5-x????? n1/n2=p1/p2=10:9??? x=0.05
αSO2=0.1mol/0.3mol=33.3%
本题难度:一般
4、填空题 一定条件下将1mol?A和1mol?B投入一密闭容器中发生如下反应A(g)+B(g)
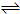
xC(g)达到平衡时,C的体积分数为W%,生成C为amol.当再投1mol?A和1mol?B重新达平衡.请用大于、小于、等于或不能确定填写在下列条件下从新达到平衡的结果.
(1)若x=1,在恒温恒容时,共有C______2amol,C的体积分数______W%.
(2)若x=1,在恒温恒压时,共有C______2amol,C的体积分数______W%.
(3)若x=2,共有C______2amol,C的体积分数______W%.
(4)若x=3,在恒温恒容时,共有C______2amol,C的体积分数______W%.
参考答案:达到平衡时,再投1mol?A和1mol?B,可等效为开始投入
本题解析:
本题难度:一般
5、填空题 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题:

(1)图中X曲线代表???????(填化学式);
(2)从开始至2min,NH3的平均反应速率是??????;
(3)第4分钟时下列叙述正确的是?????????????;
A.该反应已停止
B.单位时间内氮气的消耗速率等于氢气的生成速率
C.3v(H2)=2v(NH3)
D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2
(4)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2与3mol H2反应完全转化为NH3应_________热量(填“吸收”或“放出”)????????????????kJ。
参考答案:(1)H2?(2)0.05?mol/ (L·min)?(3)
本题解析:
试题分析:(1)根据图像可知,反应进行到2min时XYZ的浓度不再发生变化,反应达到平衡状态。此时Z的物质的量增加了0.2mol,X的物质的量减少了0.3mol,Y的物质的量减少了0.1mol,所以图中X曲线代表氢气。
(2)Z表示氨气,则从开始至2min,NH3的平均反应速率是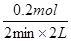 =0.05?mol/ (L·min)。 =0.05?mol/ (L·min)。
(3)反应达到平衡状态时,反应速率不是0,反应并没有停止,A不正确。根据反应速率之比是相应的化学计量数之比可知,选项B不正确;C中不满足反应速率之比是相应的化学计量数之比,C不正确。根据图像可知,选项D正确,答案选D。
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92kJ/mol,所以该反应是放热反应,放出的热量是92kJ。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生知识迁移、读图及表达能力的培养,有利于培养学生的逻辑推理能力和创新思维能力,也有助于调动学生的学习兴趣,激发学生的求知欲。
本题难度:一般
|