微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______.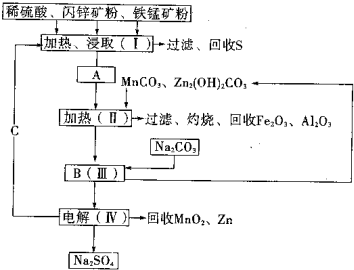
参考答案:(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化
本题解析:
本题难度:一般
2、填空题 (6分)在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
参考答案:0.1;6.5;0.5
本题解析:(1)在铜锌原电池中,锌作为负极,失去电子,发生氧化反应,反应式是Zn-2e-=Zn2+。铜左正极,溶液中的氢离子得到电子,发生还原反应,反应式是2H++2e-=H2↑。2.24L氢气恰好是0.1mol,所以转移的电子是0.1mol×2=0.2mol。
(2)根据得失电子守恒可知,溶解的锌的物质的量是0.1mol,质量是0.1mol×65g/mol=6.5g。
(3)根据原子守恒可知,原硫酸的物质的量是0.1mol,所以其浓度是 本题难度:一般
本题难度:一般
3、填空题 金属防腐的常用方法有:A、覆盖油脂;B、覆盖油漆;C、覆盖塑料;D、电镀金属;E、电化学保护法;F、制成不锈钢.请为下列钢铁制品选择一种适当的防锈方法(填写序号).
| 钢铁制品 | 手术刀 | 电线 | 自行车的钢圈 | 铁钳的转动部位 | 海水中的钢闸门 | 邮筒
防锈方法
参考答案:A、覆盖油脂,在金属表面覆盖油脂,阻止了金属和电解质溶液接触
本题解析:
本题难度:一般
4、选择题 自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是???
A.铜水龙头
B.铁水龙头
C.塑料水龙头
D.陶瓷水龙头
参考答案:B
本题解析:Cu-Fe形成原电池,Fe的活动性强于Cu,故使Fe锈蚀更快,其他选项都不形成原电池。
本题难度:一般
5、选择题 由化学能转变的热能或电能仍然是人类使用的主要能源。根据右图所示的装置,判断下列说法不正确的是
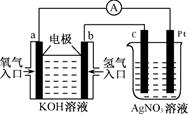
A.该装置中Pt极为阳极
B.当c极的质量变化了2.16g时,a极上消耗的O2的体积为1.12L
C.该装置中b极的电极反应式是:H2+2OH--2e-==2H2O
D.该装置中a极为正极,发生还原反应
参考答案:B
本题解析:
试题分析:左边是氢氧燃料电池,总反应为2H2+O2=2H2O,通氢气的一极为负极,电极反应式为2H2+2OH--2e-=2H2O,通氧气的一端为正极,电极反应式为O2+2H2O+4e-=4OH-。右边是电解池,c极为阴极,电极反应式为Ag++e-=Ag,Pt极为阳极,电极反应式为2H2O-4e-=4H++O2↑。由电子转移相等得:2H2~O2~4Ag,当c极增重2.16g时,a极消耗的O2为0.005mol,标准状况下为112mL,B错误。
点评:串联电路中,各个电极上通过的电子物质的量相等
本题难度:一般
|