1.00
?
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________?方向移动(填“正反应”或“逆反应”、“不移动”)。
参考答案:
I.(1)ACD (3分) (2)?? 1(2分)<
本题解析:
试题分析:I.中左边是燃料电池,右边是电解池,电解硝酸银溶液。(1)A、a电极是负极,OH-移向负极,错误;B、正确;C、反应条件不是燃烧,错误;D、反应生成水,使KOH浓度降低,pH减小,错误;E、正确;
(2)电子转移为0.112÷22.4×2=0.01mol,阳极反应为:4OH--4e-=O2↑+2H2O,
n(H+)=n(OH-)=n(e-)=0.01mol,c(H+)=0.001mol/L,pH=3;
II.(1)根据变量不变达平衡判断,反应速率判据两个方向,速率比为化
本题难度:困难
2、选择题 一定条件下在2L密闭容器中加入一定量A,发生反应:A(气)===2B(气),2B(气)===C(气)+2D(气),测得平衡时A为0.3mol/L,B为0.2mol/L,C为0.5mol/L。最初在容器里加入A的物质的量是?????????????????????????????????????????????????????????????????(??)
A.0.6 mol
B.1.8 mol
C.1.2 mol
D.1.5 mol
参考答案:B
本题解析:略
本题难度:简单
3、选择题 (4分)a1,a2分别为A在两个恒容容器中平衡体系A(g) 2B(g) 和A(g) 2B(g) 和A(g) B(g)的转化率,在温度不变的情况下,均增加A(g)的物质的量,则 a1_______,a2______,(填“减小”或“增大”或“不变”) B(g)的转化率,在温度不变的情况下,均增加A(g)的物质的量,则 a1_______,a2______,(填“减小”或“增大”或“不变”)
参考答案:减小 不变
本题解析:
试题分析:增加A(g)的物质的量,相当于加压,a1平衡左移,转化率减小;a2平衡不移动,转化率不变。
考点:本题考查平衡移动原理。
本题难度:一般
4、选择题 下列说法正确的是 ( )
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.③④⑥
B.①②⑤
C.③④⑤⑥
D.②③④
参考答案:A
本题解析:
试题分析:活化分子间的碰撞不一定能发生化学反应,①错误;只有活化分子才能发生有效碰撞,②错误;使用催化剂能提高反应速率,原因是催化剂可以降低反应的活化能,使有效碰撞频率增大,⑤错误,其余选项都是正确的,答案选A。
点评:该题是中等难度试题的考查,侧重考查学生对活化分子、有效碰撞等有关概念的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
5、选择题 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
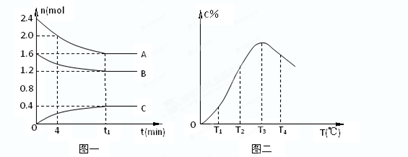 ? ?
下列分析不正确的是:(??)
A.此反应的正反应为吸热反应
B.由T1向T2变化时,V正> V逆
C.增大压强,平衡向正反应方向移动
D.0~4分钟时,A的速率为0.01mol/(L?min)
参考答案:A
本题解析:
试题分析:根据图二可知,当C的含量达到最大值时,即反应达到平衡状态时。如果继续升高温度,C的含量反而是降低的。二根据图一可知,A和B是反应物,C是生成物。这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,选项A不正确;温度越高,反应速率越大,B正确;根据图一可知,该反应的方程式是2A+B C,即正 C,即正
本题难度:一般
|