微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)制取碘盐的流程如下:
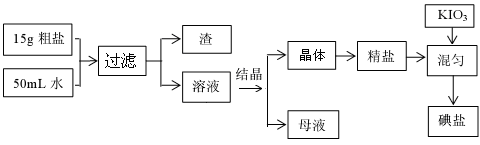
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是????????????????????????????????? ▲????????????????????????。
(2)过滤时,用到的玻璃仪器有:???? ▲???、???? ▲????、???? ▲????。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为:???????????????????? ▲?????????????????mg/Kg(保留一位小数),是否是合格产品???????????? ▲??????(填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是?????????????????????????????????????? ▲??????????????????????????。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式:?????????????? ▲??????????或??????? ▲?????????。
参考答案:(1)取少量母液先加入稀盐酸酸化,再加入BaCl2溶液,若有
本题解析:(1)检验母液中是否含有SO42-离子的方法是:取少量母液先加入稀盐酸酸化,再加入BaCl2溶液,若有白色沉淀,则说明有SO42-离子。
(2)过滤时,用到的玻璃仪器有:漏斗?玻璃棒??烧杯
(3)计算出1mL0.001mol/L KIO3中碘元素的质量,用碘元素质量除以精盐和KIO3的质量和,即可得到该碘盐的含碘量,约为25.4 mg/Kg,销售品≥30mg/Kg,所以此盐不合格。
(4)因为有碘单质生成,所以,还需要的一种试剂,最好是淀粉,因为碘遇淀粉变蓝色。
(5)碘酸钾两种情况下分解的化学方程式:2KIO3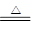 2KI+3O2↑??12KIO3+6H2O
2KI+3O2↑??12KIO3+6H2O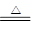 6I2+12KOH+15O2↑
6I2+12KOH+15O2↑
本题难度:一般
2、实验题 (9分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
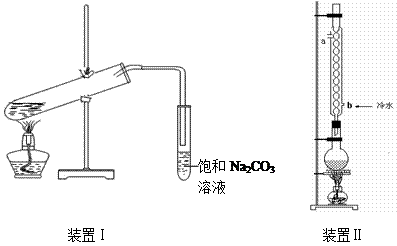
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
物??质
| 2,4,6
?
熔点/℃沸点/℃
| 密度/g·cm-3
| 乙??醇
| -114
| 78
| 0.789
| 乙??酸
| 16.6
| 117.9
| 1.05
| 乙酸乙酯
| -83.6
| 77.5
| 0.900
| 98%H2SO4
| 10
| 338
| 1.84
?
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置)??????????????????????????????????????????????,浓H2SO4的作用是???????????????????????????。
(2)要 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入????????????(填仪器名称),用力振 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入????????????(填仪器名称),用力振 荡,静置,??????????(填现象),然后将产物从_____口(填“上”或“下”)倒出。 荡,静置,??????????(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:?????????????????????????????????????????????????。
参考答案:(9分)(1)CH3CO18OH+CH3CH2OH![]()
本题解析:略
本题难度:简单
3、实验题 (15分)
请设计实验:用MnO2与浓盐酸制备纯净、干燥的Cl2,其他药品与试剂任选。
(1)写出该反应的化学方程式?????????????。
 ?(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必 ?(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必 画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如 画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如 下: 下:
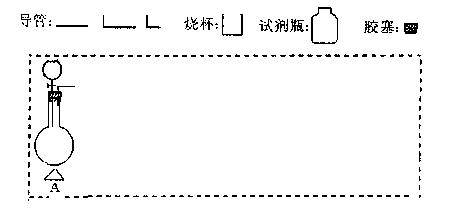
(3)根据方框中的装置图,完成下表(若无需填写,则在表格中写“无”)
仪器符号
| 仪器中所加物质
| 作用
| A
| MnO2、浓盐酸
| MnO2与浓盐酸生成Cl2
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
??(4)KMnO2与浓盐酸在常温下反应也可以得到Cl2,请写出该反应的离子方程式????。
(5)请写出Cl2在工业、农业、医疗、卫生等方面的用途??????????。(写出两种即可)
(6)将Cl2与SO4分别通人品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法。
参考答案:
(1)MnO2+4HCl(浓)![]()
本题解析:略
本题难度:简单
4、选择题 下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
A.乙酸乙酯(乙酸),加NaOH溶液、分液
B.福尔马林(乙酸),加Na2CO3溶液、分液
C.溴乙烷(乙醇),加水振荡、分液
D.苯(苯酚),加溴水振荡、过滤
参考答案:C
本题解析:A错,乙酸乙酯也能与氢氧化钠溶液反应,会发生水解反应;B错,乙酸能与碳酸钠溶液反应,但福尔马林易溶于水,不能用分液的方法处理;C正确,溴乙烷不溶于水,而乙醇易溶于水,可用分液分离;D错,苯酚与溴水反应生成的三溴苯酚能溶于苯中不能分离,正确的处理方法为加氢氧化钠溶液后分液;
本题难度:简单
5、实验题 (10分)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。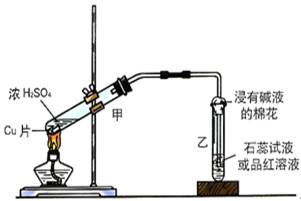
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成___________??_____。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成___________?_________。
写出甲装置中发生的主要反应的化学方程式________________________???
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:____________________________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式?????????????????????????????。
参考答案:(1)乙中品红褪成无色;甲中溶液显蓝色。Cu+2H2SO4(
本题解析:略
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|