微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”,请分别用下图中示意的两套仪器装置,制取上速铁的氧化物和“引火铁”,实验中必须使用普通铁粉、6molL-1盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
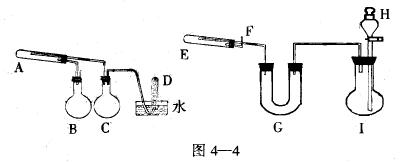
填写下列空白:
(1)实验进行时试管A中应加入的试剂是???????
烧瓶B的作用是???????;
烧瓶C的作用是????????
在试管D中收集得到的是????????
(2)实验时,U型管G中应加入的试剂是????????
分液漏斗H中应加入?????????
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应字母)??????????
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是?????????
(5)试管E中发生反应的化学方程式是?????????
(6)为了安全,在E管中的反应发生前,在F出口处必须?;E管中反应开始后,在F出口处应?????????
2、实验题 (12分)实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气。某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下(部分导管、蒸馏水略):
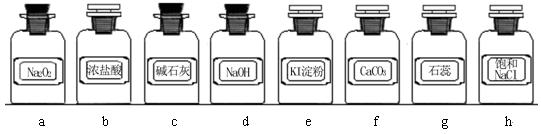
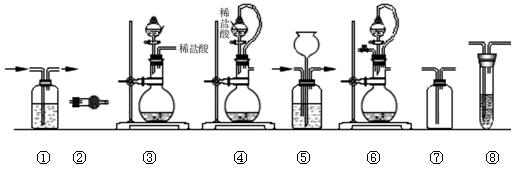
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_________________________。
(2)下列装置组合最合理的是__________?(填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
组合
| 制备装置
| 净化装置
| 检验装置/试剂
| 尾气处理装置
|
A
| ③
| ②
| ⑦/e
| ⑤
|
B
| ③、⑥
| ①
| ⑧/g
| ①
|
C
| ④
| ①
| ⑤/e
| ②
|
D
| ④、⑥
| ⑤
| ⑧/g
| ①
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:____________ 。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①? ___________________________________,②? ___________________________________。
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?___________(填“是”或“否”);理由是__________________________________________ 。
3、实验题 .某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和??????????(填字母)。?
(2)写出步骤④中发生反应的离子方程式????????????????????????????????????。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+? +? ClO3— +????????= ?Fe3+?+? Cl— +? H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成???????(填偏大、偏小或不影响),
(4)若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为?????????????????????????????????????。(列出算式,不需化简)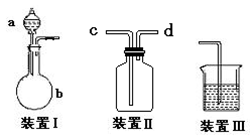
4、实验题 常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。
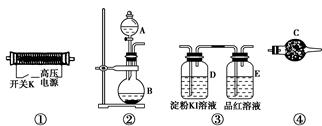
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
5、实验题 (15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸nmol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。
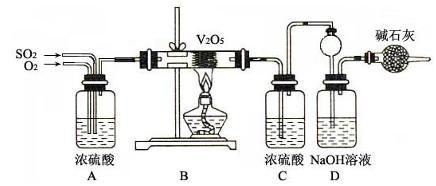
请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是
??????????????????????????????????????????????????????????????????。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有???????????????????????????????????????????????????????????????????。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号)?????。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:
?????????????????????????????????????(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为????????????;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为????????????????????????。
|