微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。已知充电时电池总反应为:LiMn2O4=Li1-xMn2O4+xLi,下列叙述正确的是
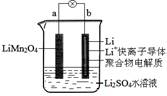
A.放电时,正极反应为xLi++xe-=xLi
B.放电时,a极锂的化合价不发生变化
C.充电时,b极发生氧化反应
D.充电时,溶液中的Li+从b极向a极迁移
参考答案:B
本题解析:
试题分析:A、放电时总反应为:Li1-xMn2O4+xLi= LiMn2O4,正极上发生LiMn2O4得电子反应,故A错误;B、放电时,a极锂的化合价均为+1价,不发生变化,故B正确;C、充电时,b极LiMn2O4转化为Li,Li元素化合价降低,发生还原反应,故C错误;D、充电时a为阳极,b为阴极,阳离子从阳极移向a极,即Li+从a极移向b极,故D错误。
考点:本题考查原电池与电解池的原理。
本题难度:一般
2、选择题 根据下列事实,判断离子的氧化性顺序为①A + B2+ = A2+ + B? ②D + 2H2O = D(OH)2+H2↑?
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+ + 2e-= E,B - 2e- = B2+??(???)
A.E2+>B2+>A2+>D2+
B.D2+>A2+>B2+>E2+
C.D2+>E2+> B2+>A2+
D.A2+>B2+>D2+>E2+
参考答案:A
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与
本题难度:一般
3、选择题 一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2═8CO2+10H2O
C.通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D.通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-=4CO2+5H2O
参考答案:BD
本题解析:
本题难度:一般
4、填空题 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
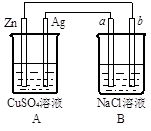
(1)A为??????????池,(填原电池、或电解池),其中的Ag极为???????极,发生???????????反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为??????极,电极反应式为???????,总反应的化学方程式为????????????。经过一段时间后,B装置中溶液的碱性?????????????(填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为??L。
参考答案:(1)原电池;正;还原
(2)阴;2H++2e-=H2
本题解析:
试题分析:(1)锌与硫酸铜可以发生自发的氧化还原反应,因此A装置是原电池。原电池中较活泼的金属作负极,则锌是负极失去电子,发生氧化反应,银是正极,溶液中的铜离子在正极得到电子发生还原反应。
(2)B装置是电解池,b电极与原电池的负极相连作阴极,溶液中的氢离子放电,电极反应式为2H++2e-=H2↑。A电极与原电池的正极相连,作阳极,溶液中的氯离子放电生成氯气,则B装置中总的化学方程式为2NaCl+2H2O 本题难度:一般
本题难度:一般
5、选择题 碱性锌锰电池的总反应是:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是( )
A.MnO2发生了氧化反应
B.MnOOH中Mn元素的化合价为+3
C.反应消耗0.65gZn,有0.01mol电子发生转移
D.电池正极的反应为:Zn+2OH--2e-═Zn(OH)2
参考答案:A.由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2M
本题解析:
本题难度:一般