微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电化学的图示,完全正确的是[???? ]
A.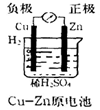
B.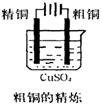
C.
D.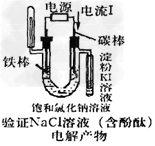
参考答案:D
本题解析:
本题难度:简单
2、选择题 原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+
B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-
参考答案:
本题解析:
本题难度:简单
3、填空题 某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
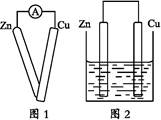
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是 ??????????????????????。
(2)实验步骤②中应观察到的现象是 ??????????????????????。
(3)实验步骤③中应观察到的现象是 ??????????????????????。
(4)实验步骤④中应观察到的现象是 ??????????????????????。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是 。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。
参考答案:(1)电流计指针不偏转
(2)锌片上有气泡产生
本题解析:形成原电池必须满足下列条件:①两块活泼性不同的金属(或一块金属,一块可导电的非金属)作两极;②电解质溶液;③形成闭合电路;④有自发的氧化还原反应。
本题难度:一般
4、选择题 控制适合的条件,将反应2Fe3++2I-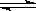 I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是

 ??? A?反应从正向开始时,乙中石墨电极上发生氧化反应
??? A?反应从正向开始时,乙中石墨电极上发生氧化反应
 ??? B?电流计读数为零时,反应达到化学平衡状态
??? B?电流计读数为零时,反应达到化学平衡状态
 ??? C?电流计读数为零后,甲乙两烧杯均加等量水稀释,电流计指针不发生偏移
??? C?电流计读数为零后,甲乙两烧杯均加等量水稀释,电流计指针不发生偏移
 D?电流计读数为零后,在甲中再溶入FeCl2固体,乙中石墨电极为正极
D?电流计读数为零后,在甲中再溶入FeCl2固体,乙中石墨电极为正极
参考答案:C
本题解析:原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。根据装置可知甲中石墨是正极,乙中石墨是负极,所以A正确。当电流计读数为零时,反应达到化学平衡状态,此时再加入FeCl2固体,乙中单质碘发生还原反应,所以乙中的石墨是是正极,因此选项BD正确。电流计读数为零后,甲乙两烧杯均加等量水稀释,则平衡被平衡,电流计指针发生偏移,所以C是错误的。答案选C。
本题难度:一般
5、选择题 下列说法中正确的是
A.在原电池中,物质在负极发生氧化反应
B.在原电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极
参考答案:A
本题解析:
试题分析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项A正确,其余选项都是错误的,答案选A。
考点:考查原电池的有关判断。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般