微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g) 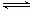 2SO3(g)?????△H=-198kJ·mol-1
2SO3(g)?????△H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是???????(填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是????????(填序号)。
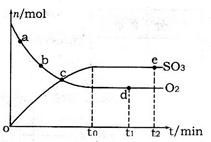
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应??????(填“是”、“否”或“无法判断”)达到化学平衡状态,理由是???????????????????????????????????????????????????????。
参考答案:(1)AD(2分)(2)AC(2分)
(3)否(2分)
本题解析:
试题分析:(1)A、每生成1mol?SO3的同时生成0.5mol?O2,说明正逆反应速率相等,反应达到平衡状态,故A正确;B、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故B错误;C、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;D、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故D正确;故选:AD;
(2)A.反应物浓度越大,反应速率越快,故a点时刻的正反应速率比b点时刻的大,故A正确;B.a、b、c三点未到达平衡状态,反应向正反应进行,故B错误;C.d、e两点处于平衡状态,温度相同,C(O2)相等,n(O2)相同,故C正确;D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡时三氧化硫的物质的量减小,故D错误;故答案为:AC;
(3)???????????? 2SO2(g)十O2(g)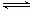 2SO3
2SO3
起始(mol/L)????????0.05??????????0.03?????????? 0?
反应(mol/L)????????0.04??????????0.02???????????0.04
一段时间后(mol/L)0.01????????? 0.01????????? 0.04
400℃时,浓度熵Q=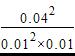 =1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
=1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
本题难度:困难
2、选择题 反应 2A(g) + B(g)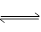 ?2C(g);△H > 0 。下列反应有利于生成C的是:
?2C(g);△H > 0 。下列反应有利于生成C的是:
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
参考答案:C
本题解析:A错,低温、低压平衡向逆反应方向移动;B错,低温平衡向逆反应方向移动,而高压向正反应方向移动;C正确,高温平衡向正反应方向移动,而高压平衡向正反应方向移动;D错,高温正反应方向移动,低压向逆反应方向移动;
本题难度:一般
3、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(?????)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(?????)

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
参考答案:D
本题解析:
试题分析:由于铅是固态,往平衡体系中加入金属铅后,平衡不移动,c(Pb2+)不变;往平衡体系中加入少量Sn(NO3)2固体后,平衡向左移动,c(Pb2+)变大;升高温度,平衡体系中c(Pb2+)增大,平衡向左移动,说明该反应是放热反应,即△H﹤0;25℃时,该反应的平衡常数K= =0.22/0.10=2.2,所以选项D正确,答案选D。
=0.22/0.10=2.2,所以选项D正确,答案选D。
点评:该题是2011年福建高考试题。此题虽然是新情景,但题目不偏不怪,只要掌握扎实的基础知识不能灵活运用加快得出正确的答案。
本题难度:一般
4、选择题 密闭容器中的可逆反应3A(g)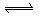 3 B+C?? ΔH="+890" kJ/mol(A的式量为120)随着温度升高,容器中气体相对平均分子质量减小,则下列判断正确的是( ).
3 B+C?? ΔH="+890" kJ/mol(A的式量为120)随着温度升高,容器中气体相对平均分子质量减小,则下列判断正确的是( ).
A.若C为固体,则B一定是气体
B.B和C一定都是气体
C.若起始时往容器中投入18 g A,则反应吸收的热量为44.5 kJ
D.若起始时往容器中投入18 g A,则反应放出的热量为44.5 kJ
参考答案:A
本题解析:略
本题难度:一般
5、选择题 将3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是[???? ]
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是[???? ]
A.
B.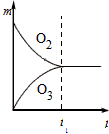
C.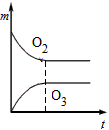
D.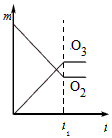
参考答案:C
本题解析:
本题难度:一般