微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,向一个容积可变的恒压容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g)? ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g)? ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
A.第一次实验平衡时反应放出的热量为98.3kJ
B.第一次实验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大
C.第二次实验达平衡时SO3的体积分数大于2/9
D.两次实验平衡时,SO3的浓度相等
参考答案:AD
本题解析:2SO2(g)+O2(g) 2SO3(g)? ΔH=-196.6 kJ·mol-1
2SO3(g)? ΔH=-196.6 kJ·mol-1
起始? 3 mol?? 2 mol?????? 0
变化? 2x????? x????????? 2x
平衡? 3—2x?? 2—x?????? 2x
根据阿伏加德罗定律的推论:同温同体积,压强之比=物质的量之比
得: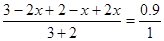 ;x=0.5
;x=0.5
根据热化学方程式可求得第一次实验平衡时反应放出的热量为98.3kJ,A对
若保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g)
则:在恒温恒压条件下:
2SO2(g)+O2(g) 2SO3(g)?ΔH=-196.6 kJ·mol-1
2SO3(g)?ΔH=-196.6 kJ·mol-1
第一组??3 mol?? 2 mol?????? 0
第二组?? 4 mol ??3 mol ??????2 mol等效于
6 mol SO2??4 mol O2??0 mol SO3(g)
即第一次实验与第二次实验互为等效平衡,所以两次平衡转化率相同,SO3的体积分数相同,浓度相等。
本题难度:一般
2、选择题 对于3W(g) + 2X(g) = 4Y(g) + 3Z(g) ,下列反应速率关系正确的是 [???? ]
A.υ(W) =3υ(Z)
B.2υ(X) =3υ(Z)
C.2υ(X) =υ(Y)
D.3υ(W) =2υ(X)
参考答案:C
本题解析:
本题难度:简单
3、填空题 (10分)接触法制硫酸的核心反应是2SO2(g)? + O2(g) 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
(1) 0min~4min内生成O2平均速率v(O2)=???????????????????;如果0min~4min内SO3生成速率平均为x,4min~8min内SO3生成速率平均为y,8min~10min内SO3生成速率平均为z(其它条件不变,且忽略反应中温度变化),则x、y、z大小关系为______________。
(2) 达到平衡时c(O2)=c(SO2),则a=???????mol·L-1;如果此时在平衡体系中加入0.5molN2,则SO2在混合气中所占的体积分数____________(填“增大”、“减小”或“不变”)
(3) 若起始时n(SO3)、n(SO2)、n(O2)(/mol)分别按下列4组数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是???????????????。
A.1、2、2
B.3、1.5、1
C.3、0、0
D.0、6、5
参考答案:(每空2分)(1)0.025mol·L-1·min-1??<
本题解析:略
本题难度:简单
4、选择题 在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是(?? )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是(?? )
A.若生成1 mol Fe,则吸收的热量小于a kJ
B.若要提高CO的转化率,则应该加入适当的过量FeO
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L
参考答案:D
本题解析:根据反应可知,每生成1 mol Fe吸收的热量为a kJ,A错;FeO为固体,对CO的转化率没有影响,B错;因为恒容容器,且反应为气体体积不变的反应,所以任何时间容器内的压强都不变,不能根据压强变化判断反应是否达到平衡状态,C错;根据K=c(CO2)/c(CO)=0.263可知,当c(CO) =
0.100 mol·L-1时,c(CO2)="0.263×0.100" mol·L-1="0.026" 3 mol·L-1,D对
本题难度:一般
5、选择题 在某温度下,可逆反应mA(g) + nB(g)  pC(g) + qD(g)的平衡常数为K,下列说法正确的是
pC(g) + qD(g)的平衡常数为K,下列说法正确的是
A.平衡常数发生变化,化学平衡必发生移动
B.化学平衡发生移动,平衡常数必发生变化
C.反应物的转化率越大,达到平衡时,K值越大
D.温度越高,达到平衡时,K值越大
参考答案:A
本题解析:正确答案A
平衡常数只随温度变化而变化,B、C不正确,对放热反应,温度越高,平衡常数越小。
本题难度:一般