微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下


由此可判断这四种金属活动性顺序是[???? ]
A.a>b>c>d???
B.b>c>d>a ?
C.d>a>b>c????
D.a>b>d>c
参考答案:C
本题解析:
本题难度:一般
2、选择题 钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O
=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
参考答案:A
本题解析:反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,1molO2在反应中得到4mol电子,同样在反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,而且两个反应中氧气的系数都是1,因此得到的电子均是4mol,故A选项正确B选项错误。钢质水管与铜质水龙头连接后形成原电池,其中钢质水管做负极被腐蚀,故C选项错误。钢铁在潮湿的空气中容易发生电化学腐蚀,而且主要是发生吸氧腐蚀,因此D选项错误。
点评:原电池知识是高中电化学的重点也是难点,难度不大,解题的关键是要正确区分正负
本题难度:简单
3、填空题 分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
金属片
| 电子流动方向
| 电压表读数
|
A
| Cu←A
| +0.67
|
B
| Cu→B
| -0.71
|
C
| Cu←C
| +1.35
|
D
| Cu←D
| +0.30

已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。
参考答案:(1)C? (2)B? (3)B
2Cu+4OH--4
本题解析:(1)两极金属活动性相差越大,电压表读数越大,表中四个原电池,电压数值绝对值C最大,且C中电子流动方向由C→Cu,故C的还原性最强。
(2)B中电流方向应Cu←B,构成原电池后,Cu作负极,故B不会与CuSO4发生置换反应。
(3)如改用NaOH作电解质,在滤纸上能看到有蓝色沉淀,溶液中应有Cu2+生成,Cu作负极,为B。
负极:2Cu+4OH--4e-====2Cu(OH)2
正极:O2+2H2O+4e-====4OH-。
本题难度:一般
4、选择题 如下图所示的装置能够组成原电池且产生电流的是[???? ]
A.
B.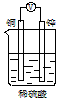
C.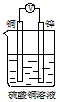
D.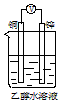
参考答案:BC
本题解析:
本题难度:简单
5、选择题 下列叙述不正确的是( )
A.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑
B.铁船船体上镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.某同学用右图所示装置完成反应:2HCl+2Ag=2AgCl↓+H2↑
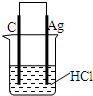
参考答案:A、工业上电解饱和食盐水时,溶液中氯离子的放电能力大于氢氧根
本题解析:
本题难度:简单
|