微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
①在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
②在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
③向0.2mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
④常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
A.①④
B.②④
C.①③
D.②③
参考答案:B
本题解析:
试题分析:①HCO3-以水解为主,c(H2CO3) > c(CO32-);②是质子守恒;③混合溶液中,同浓度CO32-水解程度大于HCO3-,且生成HCO3-,c(HCO3-) > c(CO32-) ;④CH3COONa和CH3COOH混合溶液中,电荷守恒,c(CH3COO-) =c(Na+)=0.1 mol·L-1 >c(H+)=c(OH-),因此选B。
本题难度:一般
2、选择题 下列溶液中有关物质的量浓度关系正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B.已知0.1 mol·L-1二元酸H2A溶液的pH=4,则在0.1 mol·L-1 Na2A溶液中:
c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C.将0.1 mol·L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
参考答案:B
本题解析:A、这三个溶液,分别为电离电离和水解呈碱性,故NaOH浓度最小;越弱越水解,故碳酸钠水解沉淀大;醋酸钠浓度最大;
B、质子守恒,正确;
C、c(H+)和c(OH-)乘积为定值,不可能都减小;
D、加硫酸铵平衡逆向移动;氢氧根浓度减小,氨水浓度增加。故比值减小。
本题难度:一般
3、选择题 下列水解的离子方程式正确的是
A.HS-+H2O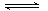 S2-+H3O+
S2-+H3O+
B.Fe3++3H2O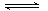 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.CO32-+2H2O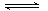 H2CO3+2OH-
H2CO3+2OH-
D.NH4++H2O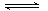 NH3·H2O+H+
NH3·H2O+H+
参考答案:D
本题解析:A:这是电离方程式,错误
B:水解是微弱过程,生成的碱不能标沉淀符号,不正确
C:多元弱酸根离子水解是分步进行的,并且以第一步水解为主,不正确
D:正确
本题难度:一般
4、选择题 现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY
B.若a>b且c(X-)=c(Y-),则酸性HX<HY
C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则a=b=0.1mol/L
参考答案:AB
本题解析:选项A中NaY水解,NaX不水解,因为酸越弱,相应的盐越容易水解,所以A正确。B中NaX的浓度,但c(X-)=c(Y-),这说明X-的水解程度大于Y-的,因此正确。PH越大,说明盐的水解程度越大,相应的酸就越弱,C不正确。由于混合后溶液的体积加倍,所以应该是a=b=0.2mol/L,D不正确。答案选AB。
本题难度:一般
5、选择题 取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
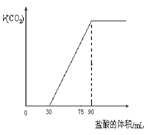
A.原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于C(HCO3-)
B.NaOH溶液中,Na+的物质的量浓度为0.18 mol/L
C.NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL。
D.0—30mL之间的离子方程式:CO32-+H+→HCO3-
参考答案:A
本题解析:
分析:由图可知,0~30mL没有气体生成,从30mL开始加盐酸生成二氧化碳气体,共消耗盐酸90mL-30mL=60mL,则NaOH溶液50mL,通入一定量CO2反应后溶液中的溶质为Na2CO3、NaHCO3,且二者的量相同,然后利用盐酸的物质的量来计算Na+的物质的量浓度及二氧化碳气体的体积.
解:因0~30mL没有气体生成,从30mL开始加盐酸生成二氧化碳气体,共消耗盐酸90mL-30mL=60mL,两个过程消耗的酸的体积比为1:2,
则NaOH溶液通入一定量CO2反应后溶液中的溶质
本题难度:一般