微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确_________________?
参考答案:(1)CH3CHO+2Ag(NH3)2OH ![]()
本题解析:
本题难度:一般
2、选择题 下列操作达不到预期目的的是( )
① 石油分馏时把温度计插入受热的液体中 ② 用酸性高锰酸钾溶液除去乙炔中含有的H2S?③ 用乙醇和3%的硫酸共热到170℃制取乙烯 ④ 将苯和溴水混合后加入铁粉制取溴苯⑤ 银氨溶液中滴入3滴甲醛溶液酒精灯加热至沸腾,产生银镜??
A.只有①⑤
B.只有③④⑤
C.只有①②③⑤
D.①②③④⑤
参考答案:D
本题解析:石油分馏时为了收集不同的馏分,温度计的水银球应放在带支管的烧瓶的支管口处,根据温度收集不同馏分,不能将温度计插入液体中,①错误;乙炔与高锰酸钾反应,所以不能用高锰酸钾除去乙炔中的硫化氢,②错误;乙醇与浓硫酸共热到170℃时才能产生乙烯,3%的硫酸的硫酸属于稀硫酸所以③错误;④中制取溴苯需要水浴加热,所以错误;银镜反应的条件是水浴加热所以⑤错误。 答案 D
本题难度:简单
3、实验题 (12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
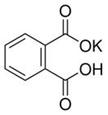
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
实验编号
| 邻苯二甲酸氢钾的质量(g)
| 待测NaOH溶液的体积(mL)
|
1
| 0.4080
| 18.20
|
2
| 17.10
|
3
| 16.90
|
4
| 17.00
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是____________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。
参考答案:(1)? 本题解析:(1)滴定终点时溶液的pH应为9.1,即溶液显碱性,所以邻苯二甲酸氢钾是弱酸的酸式盐,因此离子方程式为 本题解析:(1)滴定终点时溶液的pH应为9.1,即溶液显碱性,所以邻苯二甲酸氢钾是弱酸的酸式盐,因此离子方程式为
(2)由于终点时溶液显碱性,因此应该选择酚酞,现象是溶液颜色由无色突变到粉红色且半分钟内不再变色。
(3)根据消耗的氢氧化钠溶液体积可知,实验1的误差较大。A中氢氧化钠被稀释,所以消耗的体积就偏多,A正确;B中相当于消耗的氢氧化钠溶液体积增加,正确;锥形瓶中含有蒸馏水,不影响结果;俯视读数,读数偏小,结果偏低;液滴飞溅出来导致溶质减少,消耗的碱液体积减少;溶液颜色由无色变到了红色,说明氢氧化钠加多了,因此答案选ABF。
(4)后三次实验中氢氧化钠溶液体积的平均值是17.00ml,邻苯二甲酸氢钾是0.002mol,所以根据方程式可知氢氧化钠的物质的量也是0.002mol,所以浓度是0.002mol÷0.017L=0.118mol/L。
本题难度:一般
4、实验题 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH==?________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、淀粉-KI溶液、紫色石蕊试液。

参考答案:(1)Na2SO3+H2O
(2)Na2S![]()
本题解析:
本题难度:一般
5、实验题 (6分)在如图所示的实验装置中,当A、B、C分别为以下不同组合时,回答有关问题。
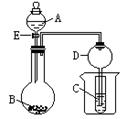
(1)当A为盐酸、B为贝壳(粉末)、C为水玻璃时,小试管中的现象是??????????,其中发生的离子反应方程式是????????????????????????????????????。
(2)当A为浓氨水、B为生石灰、C为AlCl3溶液,小试管中出现的现象是?????????,反应的离子方程式为???????????????????????。
(3)当A为浓硫酸、B为Mg、Al、Fe、Cu中的一种银白色片状金属、C为品红溶液,小试管中溶液红色褪去,则A和B反应的化学方程式是??????????????????????????。
(4)装置D的作用是 ???????????????????????????????????????。 ???????????????????????????????????????。
参考答案:(6分)(1)有白色胶状物质生成(1分) SiO32-+CO
本题解析:略
本题难度:一般
|