微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气

①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为???????????? (填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进???????????????????????????????????
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
①提出假设:(请把下列假设补充完整)假设①:该固体物质是FeCl3;假设②:?????????????? ;假设③:?????????????? 。
②设计实验方案:取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。

由此得出结论:假设????_______??成立(填序号①②③)。
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如下图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是??????????,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为???????? (假设气体全部逸出)。

参考答案:(1)①aedbcgf?????
②在C后接NaOH
本题解析:
本题难度:一般
2、填空题 某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率。请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有???????????????
??????????????????????????????????????????????????????????????(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是???????????????????;
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验(混合溶液)
| ??? A
| ??? B
| ??? C
| ??? D
| ??? E
| ??? F
|
4mol/L?盐酸/mL
| ?? 60
| ?? V1
| ??? V2
| ??? V3
| ?? V4
| ?? V5
|
饱和CuCl2溶液/mL
| ??? 0
| ?? 1.0
| ??? 5.0
| ?? 10
| ?? V6
| ?? 40
|
H2O/mL
| ?? V7
| ?? V8
| ?? V9
| ?? V10
| ?? 20
| ??? 0
??①请完成此实验设计,其中:V1=????????,V6=?????????????,V9=???????;
②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会
大大提高。但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因?????????????????????????????????????
??????????????????????????????????????????????????????????????????????????????????????????????
参考答案:(1) 升高反应温度,适当增加盐酸的浓度,增加锌粒的表面积(
本题解析:略
本题难度:简单
3、填空题 (8分)用下图所示的实验过程,测定含Na2SO4的亚硫酸钠中Na2SO3 的质量分数。
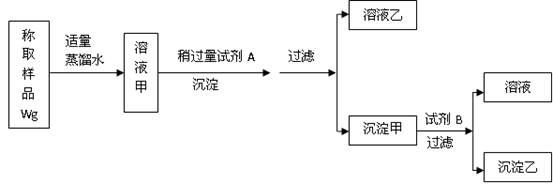
测定沉淀(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是??????????????????,沉淀乙是???????????????????;
(2)试剂B溶液选用稀盐酸,不能选用稀硝酸的原因是????????????????????????????;
(3)沉淀甲与试剂B反应的离子方程是?????????????????????????????????????????;
(4)计算含Na2SO4的亚硫酸钠中Na2SO3 的质量数???????????????????????????????。
参考答案:(1)BaCl2或Ba(OH)2溶液; BaSO4
(
本题解析:本题重点考察学生对硫酸盐和亚硫酸盐性质的掌握程度。取固体加入蒸馏水之后,获得了Na2SO4和Na2SO3的水溶液,当向其中加入过量A时产生了沉淀,由于高中化学中BaSO4是一种常见的沉淀,学生很容易会想的加入了Ba2+ 所以试剂A中含有Ba2+ ,可以为BaCl2或Ba(OH)2溶液,同时由此可判断沉淀甲为BaSO4和BaSO3的混合物,溶液乙为NaCl,由于加入试剂 B后产生了溶液和沉淀乙,说明沉淀可能部分发生了溶解,结合沉淀物的性质可判断溶剂B为酸,亚硫酸钡溶于酸,而硫酸钡不溶于酸。
(1)试剂A是BaCl2或Ba(OH)2溶液;沉淀乙不溶于试剂B所以沉淀是BaSO4
(2))硝酸具有强氧化性会将亚硫酸钡氧化为硫酸钡,这样无法分离出混合沉淀中原有的硫酸钡,最后无法计算样品中亚硫酸钠的质量分数。
(3)沉淀甲为BaSO4和BaSO3的混合物,当向其中加入酸时会与BaSO3会与酸反应离子反应方程式为
(4)根据反应后剩下沉淀乙硫酸钡的质量计算出其物质的量W1,反应过程中硫酸根离子物质的量守恒可以得出混合物样品中硫酸钠的物质的量,进而求出硫酸钠的质量,用总质量减去硫酸钠的质量即可求出亚硫酸钠的质量,即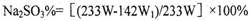
本题难度:一般
4、实验题 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)??铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
①?配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
②?加入锌粉的目的是________。
③?写出步骤三中发生反应的离子方程式________。
④?实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2)??结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、选择题 只用一种试剂可区别Na2SO4、AlCl3、NH4Cl、CuSO4四种溶液,这种试剂是( )
A.HCl
B.BaCl2
C.AgNO3
D.NaOH
参考答案:A.加入盐酸,不发生任何反应,不能鉴别,故A错误;
B
本题解析:
本题难度:一般
|