微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氧族元素的各种性质可归纳整理为如下图所示的表格(部分)
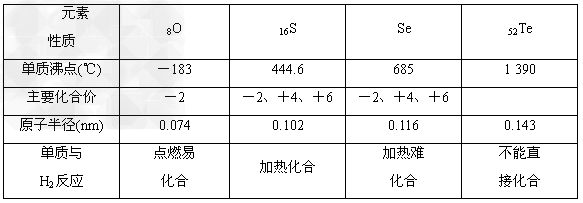
回答下列问题:
(1)硒的原子结构示意图为________。
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式___________________________________________。
(3)碲的主要化合价可能有________。
(4)工业上可用Al2Te3制备H2Te,化学方程式为__________________________________。
参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
2、选择题 下列化学用语错误的是( )
A.NaCl的电子式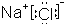
B.甲烷的结构式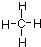
C.Mg原子结构示意图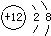
D.乙烯的结构简式CH2=CH2
参考答案:A.NaCl的电子式为 本题解析:
本题解析:
本题难度:一般
3、选择题 A,B两种元素的原子,当它们都获得2个电子形成稳定结构的阴离子时,A放出的能量大于B,由此可知:
A.稳定性:H2A>H2B
B.还原性:A2->B2-
C.原子半径:A>B
D.非金属性:A
参考答案:A
本题解析:
本题难度:简单
4、选择题 有A、B、C、D四种短周期元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A单质的还原性比B单质的还原性强,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是
A.B > A > C > D?????
B.C > B > A > D???
C.A > B > C > D?????
D.B > A > D > C
参考答案:D
本题解析:“A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构”说明四者在相邻的周期,A、B在下一周期,C、D在上一周期;“A单质的还原性比B单质的还原性强”说明A原子的失电子能力强于B,则同周期A在左、B在右;“C的阴离子所带负电荷比D的阴离子所带负电荷多”说明C在左、D在右;故选D;
本题难度:困难
5、推断题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_____________。
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式_____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____________。
(4)E的核外电子排布式是_____________,ECl3形成的配合物的化学式为_____________,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是__________________________。
参考答案:(1)C<O<N
(2)三角锥形;sp3
(3
本题解析:
本题难度:一般