微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)2.8g 铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。
求:
(1)产生的气体在标准状况下的体积。
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。
(3)稀硫酸的物质的量浓度。
参考答案:(1)1.12L(2)0.5mol/L (3)0.5mol/
本题解析:略
本题难度:简单
2、选择题 下列有关物质的性质与应用不相对应的是
A.SO2具有氧化性,可用于漂白纸浆
B.淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在
C.Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
参考答案:A
本题解析:分析:A.利用二氧化硫的漂白性来漂白纸浆;
B.淀粉溶液遇碘变成蓝色,为淀粉的特性;
C.钝化可阻止反应的进一步进行;
D.金属能导电,活泼金属在原电池中作负极.
解答:A.因二氧化硫具有漂白性,则可利用其来漂白纸浆,性质与应用不相对应,故A选;
B.淀粉溶液遇碘变成蓝色,为淀粉的特性,则可用来检验碘的存在,性质与应用相对应,故B不选;
C.Fe在常温下遇浓硫酸发生钝化,钝化可阻止反应的进一步进行,则可用铁制容器盛放冷的浓硫酸,性质与应用相对应,故C不选;
D.金属能导电,活泼金属在原电池中作负极,Zn具有还原性和导电性,则可用作锌锰干电池的负极材料,性质与应用相对应,故D不选;
故选A.
点评:本题考查物质的性质与用途,熟悉物质的性质是解答本题的关键,注意性质决定物质的用途,题目难度不大.
本题难度:简单
3、选择题 臭氧的氧化性很强。下列物质中,能破坏大气臭氧层的是(??? )
①SO2? ②CO2? ③CO? ④N2? ⑤氟利昂(CCl2F2)? ⑥NO
A.①③⑤
B.①③⑤⑥
C.①②③⑤⑥
D.全部
参考答案:B
本题解析:O3是强氧化剂,还原性物质SO2、CO、CCl2F2、NO等都能与之反应。
本题难度:简单
4、实验题 (16分)测定化成SO3的转化率可以用题27—1图装置,装置中烧瓶内发生的化学反应方程式为: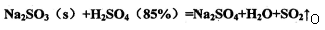
(已知S03的熔点是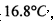 沸点是
沸点是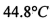 )
)
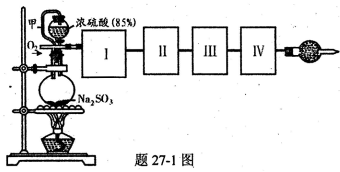
(1)装置中甲管的作用是__________________。
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从题27?2图A?E装置中选择最适合装置并将其序号填放下面的空格中。
I、 II、III、IV处连接的装置分别是________________________
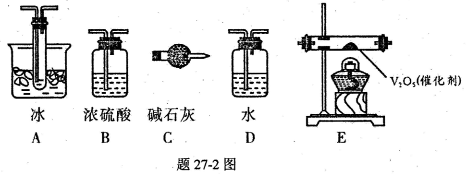
(3)??为使SO2有较高的转化率,实验中加热fi化剂与滴加浓硫酸的顺序中,应采取的操作是______________________________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)??有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)
①原因:______②原因:______ ③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有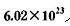 个电子转移,则该反应的化学方程式为__________________
个电子转移,则该反应的化学方程式为__________________
(6)用 粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2 —段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为__________________.(用含m、n的代数式填写)
粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2 —段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为__________________.(用含m、n的代数式填写)
参考答案: 本题解析:略
本题解析:略
本题难度:一般
5、选择题 标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )。
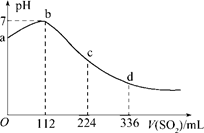
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
参考答案:A
本题解析:SO2具有氧化性,而H2S具有还原性,二者发生氧化还原反应,方程式为SO2+2H2S===3S↓+2H2O,所以开始阶段pH试管,A正确;根据图像二者恰好反应时,消耗SO2水112ml,则H2S是0.01mol,所以浓度是0.1mol/L,C不正确;当H2S完全被氧化后,再通入SO2,则SO2和水反应生成亚硫酸,溶液当酸性增强,因此BD不正确,答案选A。
本题难度:一般