?
?
②A中发生反应的离子方程式为????????????????????????????。
③实验时C中的实验现象是???????????????????????????????。
④D装置的作用是???????。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明: ??????????????????????????。
参考答案:(1)①试管中液面上升,溶液pH<7
②将二氧化硫气体
本题解析:(1)二氧化硫在水中的溶解度较大,将盛满SO2气体的试管倒立在水中,由于二氧化硫的溶解造成试管内压强减小,导致液面上升。同时,二氧化硫的水溶液即亚硫酸呈酸性,所以溶液的pH<7。验证二氧化硫与碱反应时,由于题目要求“出现白色沉淀”,因此不能用NaOH、KOH等碱溶液,必须用Ba(OH)2或Ca(OH)2等碱溶液。(2)根据所提供的药品,验证二氧化硫的还原性,可选择具有强氧化性的酸性高锰酸钾溶液。品红溶液显然是验证二氧化硫的漂白性,现象是品红溶液褪色。具有还原性的Na2S判断SO2具有氧化性。二氧化硫的水溶
本题难度:一般
2、选择题 往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时产生白色沉淀。下列有关说法中不正确的是(???)
A.白色沉淀为BaSO4
B.反应后溶液的pH减小
C.此实验表明SO2有漂白性
D.此实验中Fe3+表现出氧化性
参考答案:C
本题解析:涉及反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+?????? SO42-+Ba2+=BaSO4↓
可见反应后生成了强酸,酸性增强,pH减小,Fe3+在反应中表现氧化性,SO2表现还原性
C符合题意
本题难度:一般
3、实验题 (14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高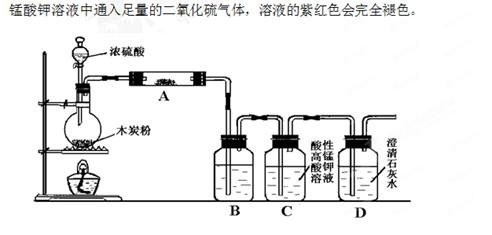
(1)组装好上述装置后,首先要进行的操作是:?????????????。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:???????????????。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是????????、?????????;B中加入的试剂和作用是????????????、????????????。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:??????????。
参考答案:(每空2分,共14分)(1)检查装置的气密性。(2)2H2S
本题解析:
试题分析:(1)在有关气体的实验中,组装好仪器之后均要进行气密性的检查;(2)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水;(3)检验产物先用无水硫酸铜粉末检验水;再用品红溶液检验二氧化硫,除去二氧化硫之后,再通过澄清石灰水检验二氧化碳;(4)只有二氧化硫除干净了,澄清石灰水变浑浊才能说明有二氧化碳生成,根据装置图分析,只有酸性高锰酸钾颜色不褪尽才能说明二氧化硫已除干净。
本题难度:一般
4、选择题 将质量分数a%的氨水与质量分数b%的氨水等质量混合所得溶液的密度为X1,将质量分数a%的氨水和质量分数b%的氨水等体积混合所得溶液的密度为Y1。将质量分数a%的硫酸与质量分数b%的硫酸等质量混合所得溶液的密度为X2,将质量分数a%的硫酸与质量分数b%的硫酸等体积混合所得溶液的密度为Y2。则X1、Y1、X2、Y2的大小关系为(??)
A.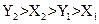
B.
C.
D.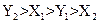
参考答案:A
本题解析:略
本题难度:简单
5、选择题 “绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下面化学反应不符合绿色化学概念的是
A.消除硫酸厂尾气排放:SO2+2NH3 = (NH4)2SO3
B.消除制硝酸工业尾气排放:NO2+NO+2NaOH =2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2= 2CuO CuO+H2SO4(稀) = CuSO4+H2O
参考答案:C
本题解析:
试题分析:A、用氨水吸收含二氧化硫的尾气,减少对空气的污染,正确;B、将氮的氧化物气体转化为固态亚硝酸盐,减少对空气的污染,正确;C、用铜与浓硫酸共热制取硫酸铜,产生二氧化硫气体,对环境造成污染,错误;D、铜与氧气反应生成氧化铜,氧化铜再与稀硫酸反应制取硫酸铜,不产生二氧化硫,对环境无污染,且耗用硫酸较少,正确,答案选C。
本题难度:一般
|