微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在2A+B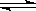 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
A.vA=0.5mol·L-1·min-1
B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1
D.vD=1mol·L-1·min-1
参考答案:B
本题解析:同一个化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的。所以在比较反应速率快慢时,应该换算成用同一种物质表示,然后才能直接比较速率数值大小。根据速率之比是相应化学计量数之比可知,如果都用物质A表示反应速率,则分别是0.5mol·L-1·min-1、0.6mol·L-1·min-1、0.53mol·L-1·min-1、0.5mol·L-1·min-1,所以答案选B。
本题难度:一般
2、选择题 下列有关化学反应速率的说法正确的是 [???? ]
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
参考答案:D
本题解析:
本题难度:一般
3、简答题 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
(1)①该反应的化学方程式是______.
②在t1min时,该反应达到了______状态,下列可作为判断反应已达到该状态的是______
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2:3
C.生成3mol?Y的同时生成1mol?Z
D.生成1mol?Z的同时生成2mol?X??
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为:______;在此t1min时间内,用H2表示反应的平均速率v(H2)=______.
②两位同学讨论放热反应和吸热反应.甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应.你认为他们说法正确的是______同学.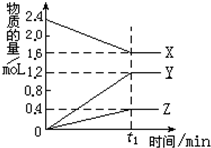
参考答案:(1)①由图象可以看出,反应中X的物质的量减小,Y、Z的物质
本题解析:
本题难度:一般
4、实验题 (12分)Ⅰ试写出中学阶段常见的两种制取氧气的化学方程式:
?????????????????????????????????;???????????????????????????????????????。
Ⅱ.实验室中通常用MnO2作催化剂分解过氧化氢,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:??????????????????????????????????????????????????。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Cl-。
你认为最不可能的是???????同学的猜想,理由是????????????????????????????。
(3)同学们对余下的两个猜想,用实验进行了探究,并记录如下,请你仔细分析后填表:
实验过程?实验现象?结论
实验过程
| 实验现象
| 结论
|
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管.
| 无明显现象
| ??????????????
??????????????
|
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管.
| 试管中有大量气泡产生,带火星的木条复燃?
| ??????????????
??????????????
参考答案:I.H2O2MnO2 H2O+O2↑(2分)、
本题解析:I.制取氧气,可用双氧水分解、氯酸钾分解或高锰酸钾分解,也可用利用过氧化钠和水反应制取氧气。
II.(1)氯化铁能作为双氧水分解的催化剂,所以会产生氧气,氧气能使带火星的木条复燃。
(2)由于过氧化氢溶液中就含有大量的水,所以水不可能是催化剂。
(3)加入盐酸,不能产生氧气,这说明起催化剂作用的不是氯离子。而加入硫酸铁能够产生大量的氧气,就说明起催化剂作用的是铁离子。
本题难度:一般
5、选择题 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是 4NO(g)+6H2O(g),下列叙述中正确的是
A.化学反应速率的关系是2v正(NH3)=3v正(H2O)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4v正(O2)=5v逆(NO)
参考答案:D
本题解析:
试题分析:化学反应速率之比等于化学计量数之比,所以3v正(NH3)=2v正(H2O),A项错误;生成NO表示V (正),而消耗NH3指的是V (正),B项错误;增大容器的体积,正反应速率增大,逆反应速率也增大, C项错误;达到化学平衡时4v正(O2)=5v逆(NO),说明反应达到化学平衡状态,D项正确;选D。
考点:考查化学反应速率及大小比较,平衡状态的判断等知识。
本题难度:一般
|