微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.生成物总能量一定低于反应物总能量
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同
H不同
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H =-38.6 kJ/mol
H =-38.6 kJ/mol
D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol
O2 反应放出115.6 kJ热量,键能如下表所示,则断裂1 mol
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ
?
参考答案:D
本题解析:
试题分析:A、在放热反应中生成物总能量一定低于反应物总能量,而在吸热反应中正好相反,错误;B、同一化学反应方程式相同条件下的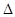 H相同,错误;C、0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应,反应物未全部转化为生成物,1mol氮气完全转化为氨气放出的热量应大于38.6kJ,所以N2(g
H相同,错误;C、0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应,反应物未全部转化为生成物,1mol氮气完全转化为氨气放出的热量应大于38.6kJ,所以N2(g
本题难度:一般
2、选择题 已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
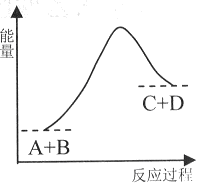
A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
参考答案:D
本题解析:
试题分析:根据图像可知,反应物的总能量低于生成物的总能量,所以正反应是吸热反应,A、C不正确。反应是放热反应还是吸热反应,与反应条件没有关系,只与反应物和生成物总能量的相对大小有关系,B不正确;反应热还等于断键吸收的能量和形成化学键所放出的能量的差值,则根据反应吸热可知,反应中断开化学键吸收的总能量高于形成化学键放出的总能量,D正确,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。明确反应热和反应物总能量与生成物总能量的相对大小是答题的关键,有助于培养学生的逻辑思维
本题难度:简单
3、填空题 同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)====P4O10(s)
ΔH="-2" 983.2 kJ·mol-1①
P(s,红磷)+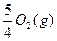 ====
====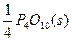 ?
?
ΔH="-738.5" kJ·mol-1②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。
参考答案:P4(s,白磷)====4P(s,红磷)
ΔH="-2
本题解析:①-4×②得P4(s,白磷)=4P(s,红磷)? ΔH=ΔH1-4ΔH2="-2" 983.2 kJ·mol-1-4×(-738.5 kJ·mol-1)="-29.2" kJ·mol-1,即P4(s,白磷)====4P(s,红磷)? ΔH="-29.2" kJ·mol-1。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳 定)。
本题难度:简单
4、选择题 下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.同温同压下,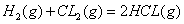 )在光照和点燃条件的△H相同
)在光照和点燃条件的△H相同
C.根据碘与氢气反应的热化学方程式
①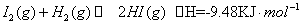 ?
?
②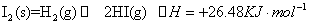 ?
?
则反应②的反应物总能量比反应①的反应物总能量低
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,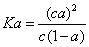 。若加入少量醋酸钠固体,则CH3COOH;—一CH3COO -十H+向左移动,a减小,Ka变小若加入少量醋酸钠固体,则
。若加入少量醋酸钠固体,则CH3COOH;—一CH3COO -十H+向左移动,a减小,Ka变小若加入少量醋酸钠固体,则
 十H+向左移动,a减小,Ka变小
十H+向左移动,a减小,Ka变小
参考答案:D
本题解析:
试题分析:A.正确,熔化热只相当于0.3 mol氢键。B.正确,反应热和反应条件是无关系的,只与反应物和生成物总能量的相对大小有关系。C.正确,反应①是放热反应,而反应②是吸热反应,则反应②的反应物总能量比反应①的反应物总能量低。Ka只与温度有关,与浓度无关,所以选项D不正确,答案选D。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于
本题难度:一般
5、选择题 将1mol?A(g)和2mol?B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )

A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol?L-1?s-1
B.该温度下,反应的平衡常数数值约为7.36
C.恒温条件下,缩小反应容器体积可以使反应?的过程按图I中a曲线进行
D.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小
参考答案:A、根据反应方程式的化学计算量数关系可知,VA=VC=
本题解析:
本题难度:简单