微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,正确的是 ( )
A.澄清石灰水中通入过量CO2:CO2+OH-=HCO3-
B.石灰石与稀盐酸反应:CO32-+2H+=H2O+CO2↑
C.碳酸氢钠溶液中滴加硫酸氢钠溶液:CO32-+2H+=H2O+CO2↑
D.碳酸氢钙溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
参考答案:A
本题解析:A正确;B错,石灰石为难溶物不能拆成离子形式;C错,正确为:HCO3-+H+=H2O+CO2↑;D错,正确为:Ca2++2HCO3-+2OH-=CaCO3↓+H2O+CO32—;
本题难度:一般
2、填空题 现有以下物质:①Al;②稀硫酸;③NaHCO3;④液氨;⑤盐酸;⑥蔗糖溶液;⑦无水乙醇;⑧熔融NaOH;⑨NaHSO4;⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有 ;
(2)属于非电解质的有 ;
(3)请写出③的电离方程式 ;
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式 ;
(5)写出①与⑧中的物质的溶液反应的离子方程式 。
参考答案:(1)①②⑤⑧
本题解析:
试题分析:溶于水或在熔融状态下能电离出离子的化合物是电解质,溶于水和在熔融状态下都不能电离出离子的化合物是非电解质。铝是金属,不是电解质也不是非电解质,但铝可以导电。稀硫酸是混合物,不是电解质也不是非电解质,但稀硫酸溶液中含有离子,可以导电。碳酸氢钠是电解质,固态不能电离,因此不能导电。液氨是氨气,属于非电解质,不能导电。盐酸是混合物,不是电解质也不是非电解质,但盐酸溶液中含有离子,可以导电。蔗糖溶液是混合物,不是电解质也不是非电解质,不能导电;无水乙醇是非电解质,不能导电。熔融的氢氧化钠是电解质,电离出了离子,可以导电;硫酸氢钠是电解质,固态不能电离,因此不能导电。CO2是非电解质,不能导电。
(1)可以导电的有①②⑤⑧。
(2)属于非电解质的有④⑦⑩。
(3)碳酸氢钠完全电离,其电离方程式为NaHCO3=Na++HCO3-。
(4)氢氧化钠能和硫酸氢钠反应生成氯酸钠和水,乙醇⑧中的物质的溶液与⑨的溶液反应的离子方程式为OH-+H+=H2O。
(5)金属铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,因此①与⑧中的物质的溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2 ↑。
考点:考查电解质、非电解质、溶液导电性判断以及离子方程式和电离方程式的书写
本题难度:一般
3、填空题 (10分)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。请回答下列问题:
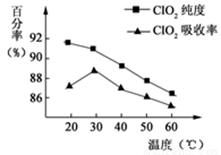
(1)由图可知,反应时需要控制的适宜温度是 ℃。
(2)黄铁矿中的硫元素在酸性条件下被ClO3—氧化成SO42—,写出制备二氧化氯的离子方程式 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得500mLClO2溶液,取出25.00mL,加入42.00mL0.500mol·L—1(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500mol·L—1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下:
4H++ClO2+5Fe2+==Cl—+5Fe3++2H2O
14H++Cr2O72—+6Fe2+ ==2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(请写出计算过程)。
参考答案:21.(1)30℃ (2)15ClO3—+FeS2
本题解析:
试题分析:(1)由图可知,ClO2气体的吸收率30℃时最高,控制100℃以下可用水浴加热,答案:30℃;
⑵-1价的S被氧化成+6价,+2的Fe被氧化成Fe3+,ClO3
本题难度:困难
4、选择题 下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32- ==CO2?+H2O
B.铁和稀硫酸反应:Fe+2H+ ==H2?+Fe3+
C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-==Al(OH)3?
D.NaHCO3溶液与NaOH溶液反应:OH- +HCO3- ==CO32- +H2O
参考答案:D
本题解析:大理石是难溶性的,用化学式表示,A不正确。铁和稀硫酸反应生成物是硫酸亚铁和氢气,B不正确。氢氧化铝是两性氢氧化物,能溶于强碱中,因此选项C中生成物应该是偏铝酸钠和水,C不正确,所以正确的答案选D。
本题难度:简单
5、选择题 能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH
参考答案:
本题解析:
本题难度:一般