微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请选择合适的试剂进行除杂,必写出相关反应的化学方程式.
(1)除去NaCl固体中混有Na2CO3,选用的试剂______.写出有关反应的化学方程式:______.
(2)除去NaOH溶液中混有Na2CO3,选用的试剂______.写出有关反应的化学方程式:______.
(3)除去氧气中混有二氧化碳气体,选用的试剂______、______.写出有关反应的化学方程式:______.
参考答案:(1)除去NaCl固体中混有Na2CO3,要除去碳酸钠,可选
本题解析:
本题难度:简单
2、填空题 写出下列反应的化学方程式
(1)Al与NaOH溶液反应:______
(2)Na2O2与CO2反应:______
(3)写出铁与水蒸气反应的化学方程式______
(4)写出碳酸钠水解的离子方程式______
(5)苯与溴反应的化学方程式______,反应类型______.
参考答案:(1)铝和氢氧化钠溶液 反应生成偏铝酸钠和氢气,反应的化学方
本题解析:
本题难度:一般
3、选择题 下列化学用语表示正确的是(???)
A.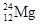 和
和 互为同位素
互为同位素
B.氯原子的结构示意图
C.氯化钠的电子式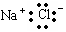
D.乙酸与甲酸互为同分异构体
参考答案:A
本题解析:A中质子数相同,中子数不同,互为同位素。氯原子的最外层电子数是7个,B不正确。氯化钠是离子化合物,电子式为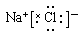 ,C不正确。分子式相同,而结构不同的化合物互为同分异构体,D中分子式不同,应该是同系物,D不正确。答案选A。
,C不正确。分子式相同,而结构不同的化合物互为同分异构体,D中分子式不同,应该是同系物,D不正确。答案选A。
本题难度:一般
4、计算题 用98%的浓H2SO4(ρ=1.84g/cm3)配制成1.84mol/L的稀H2SO4 500ml,计算所需浓H2SO4的体积。(注意:要求写出简单的计算步骤。)
参考答案:50ml
本题解析:稀释前后,溶质的物质的量不变、质量均不变
设所需浓H2SO4的体积为V,则
1.84V×98%=1.84mol/L×0.5L×98 g.mol-1
求得:V=50ml
本题难度:简单
5、填空题 (12分)酸浸法制取硫酸铜的流程示意图如下

(1)步骤①中Cu2(OH)2CO3发生反应的化学方程式为 。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定
(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
c.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
d.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
参考答案:(共12分)
(1)Cu2(OH)2CO3+2H2SO
本题解析:
试题分析:(1)步骤①中Cu2(OH)2CO3与硫酸反应生成硫酸铜、水、二氧化碳,化学方程式为Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O;
(2)在步骤③发生的反应中,二氧化锰与亚铁离子发生氧化还原反应,1mol MnO2转移2mol 电子,则Mn元素的化合价降低2价,生成锰离子,Fe元素的化合价升高到+3价,则离子方程式为MnO2+2Fe2++4H+====Mn2++2Fe3++2H2O;
(3)①碘使淀粉变蓝色,所以开始溶液为蓝色,滴入Na2S2O3溶液,溶液的蓝色逐渐褪去,滴入最后一滴Na2S2O3溶液时,溶液蓝色恰好褪去,且半分钟内不再恢复到原来颜色;
②加入足量的KI则铁离子与碘离子反应生成碘单质,再与Na2S2O3溶液发生氧化还原反应,所以2Fe3+~I2~2Na2S2O3,则n(Fe3+)=2n(I2) =n(Na2S2O3)="0.2500" mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol;红色粉末为氧化铁,则n(Fe3+)=2(Fe2O3)=2×0.600g/160g·mol-1=7.50×10-3 mol;与氯化钡溶液反应产生硫酸钡沉淀,则n(SO42-)="1.165" g ÷233 g·mol-1=5.00×10-3 mol;
则100 mL溶液中含有n(Fe3+)= 7.50×10- 3mol×4=" 0.03" mol,n(SO42-)= 5.00×10-3 mol×4=" 0.02" mol ,根据质量守恒和正负化合价代数和为0,得
4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
0.03×3+ n(NH4+)=2×0.02+n(OH-)
解得 n(NH4+)="0.01" mol,n(OH-)="0.06" mol
x∶y∶m∶n=n(NH4+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NH4Fe3(SO4)2(OH)6 。
考点:考查对流程的分析,方程式的书写,物质化学式的计算
本题难度:困难