微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于放热反应的说法中错误的是???????(?????)???????????????????????????????????
A.放热反应生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量
B.放热反应反应物总能量大于产物总能量,△H<0
C.放热反应不用加热就可以进行
D.多数化合反应、所有的燃烧、酸碱中和反应、金属与酸反应为放热反应
参考答案:C
本题解析:略
本题难度:简单
2、填空题 已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l)?????? ⊿H1= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g)?????? ⊿H2= —241.8kJ/mol
③C(s)+1/2O2 (g) =" CO" (g)?????????????? ⊿H3= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g)??????????????? ⊿H4= —393.5kJ/mol
回答下列问题:
(1)比较⊿H1, ⊿H2,⊿H3, ⊿H4的大小???????????????
(2)上述反应中属于放热的是???????
(3)H2的燃烧热为????????????????,C的燃烧热为???????????????
(4)燃烧10g H2生成液态水,放出的热量为?????????????????????????
(5)CO的燃烧热为?????????,其热化学方程式为??????????????????
(6)分别燃烧1mol C,H2,CO;充分燃烧后它们放出的热量分别为Q1,Q2,Q3
试比较Q1,Q2,Q3的大小???????????????????????????
参考答案:(1) ⊿H3 >⊿H2, , >⊿H1,
本题解析:略
本题难度:简单
3、实验题 某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。?
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。?
名称
| 托盘天平
(带砝码)
| 小烧杯
| 坩埚钳
| 玻璃棒
| 药匙
| 量筒
|
仪器
| 
| 
| 
| 
| 
| 
|
序号
| a
| b
| c
| d
| e
| f
?
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。?
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验
次数
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差平均值
(t2-t1)/℃
| H2SO4
| NaOH
| 平均值
| 1
| 26.2
| 26.0
| 26.1
| 30.1
| ?
| ?
| 2
| 27.0
| 27.4
| 27.2
| 33.3
| ?
| 3
| 25.9
| 25.9
| 25.9
| 29.8
| ?
| 4
| 26.4
| 26.2
| 26.3
| 30.4
| ?
?
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。?
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。?
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)10.0 (2)abe
Ⅱ.(1)环形玻璃搅
本题解析:考查一定物质的量浓度溶液的配制、中和热的测定以及误差分析等
Ⅰ.(1)由于没有470 mL的容量瓶,所以应该配制500 mL 0.50 mol·L-1NaOH溶液。所以需要氢氧化钠的质量是500 mL×10-3×0.5 mol/L×40 g/mol="10.0" g。
(2)氢氧化钠具有腐蚀性和吸水性,所以应该放在烧杯中称量,同时还需要药匙取NaOH固体,所以正确的答案选abe。
Ⅱ.(1)在中和热的测定实验中,溶液是需要搅拌的,所以还缺少环形玻璃搅拌棒。
(2)①四次实验的温度差
本题难度:一般
4、选择题 下列说法中错误的是
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量相对大小决定该反应是吸热反应还是放热反应
参考答案:C
本题解析:反应是放热反应还是吸热反应与反应条件无关,只与反应物和生成物能量的相对大小有关系,所以选项C是错误的,其余都是正确的。答案选C。
本题难度:简单
5、填空题 (Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为???????????。
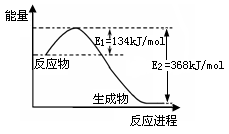
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式????????????????????????????????。
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),??
已知:2H2(g)+O2(g)==2H2O(l) △H=" -483.6" kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H="+67.8" kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H="-92.0" kJ/mol
请计算NH3 (g)的燃烧热??????????????????????????????。
温度
| 平衡浓度/ (mol?L-1)
| c(NH3)
| c(CO2)
| T1
| 0.1
| ?
| T2
| ?
| 0.1
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是????????????? 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是?????????????
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分
| 含量/(mg?L-1)
| 成分
| 含量/(mg?L-1)
| Cl-
| 18980
| Ca2+
| 400
| Na+
| 10560
| HCO3-
| 142
| SO42-
| 2560
| Br-
| 64
| Mg2+
| 1272
| ?
| ?
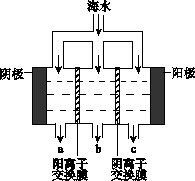 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是?????????????????。
(2)在阴极附近产生少量白色沉淀,其成分有?????和CaCO3,生成CaCO3的离子方程
式是?????????????。
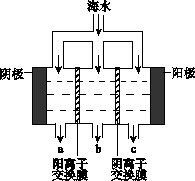 ? ?
(3)淡水的出口为???????(填“a”、“b”或“c”)。
参考答案:Ⅰ、(1) 10% (1分)
(2) NO2(g) +
本题解析:Ⅰ(1)生成氨气0.4mol,需要氮气0.2mol,故转化率是10%。
(2)由图可知反应放热,放出的能量是368kJ/mol-134 kJ/mol=234 kJ/mol,所以其热化学方程式为NO2(g) + CO(g) =" NO(g)" + CO2(g)?△H = -234KJ/mol。
(3)考查盖斯定律的应用。将已知的3个反应分别设为①②③,则①×3-③×2+②×2即得到4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),即△H=-1131.2 KJ/mol。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|