x
?
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=????????kJ·mol-1(用含a、b、c、d的代表数式表示)。
参考答案:(1)减小 不变 NO2(g)+CO(g)===CO2(g)
本题解析:(1)观察图像,E1应为反应的活化能,加入催化剂反应的活化能降低,但是ΔH不变;1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO的反应热数值即反应物和生成物的能量差,因此该反应的热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
(2)观察方程式,利用盖斯定律,将所给热化学方程式作如下运算:②×3-①×2+③×2,即可求出甲醇蒸汽燃烧的热化学方程式。
(3)白磷燃烧的化学方程式为P4+5O2  本题难度:一般 本题难度:一般
2、选择题 已知热化学方程式: H2O(g)=H2(g) +1/2O2(g)?△H = +241.8kJ/mol
H2(g)+ 1/2O2(g)=H2O(1)?△H =" -" 285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是????(??)
A.吸热44kJ
B.吸热2.44KJ
C.放热44kJ
D.放热2.44KJ
参考答案:B
本题解析:略
本题难度:简单
3、选择题 对于mA(g)+nB(g) 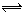 pC(g)+qD(g)的平衡体系,当升高温度时体系的平均相对分子质量减少。则下列说法正确的是?(?????) pC(g)+qD(g)的平衡体系,当升高温度时体系的平均相对分子质量减少。则下列说法正确的是?(?????)
A.m+n >p+q,正反应是放热反应
B.m+n >p+q,正反应是吸热反应
C.m+n<p+q,逆反应是放热反应
D.m+n <p+q,逆反应是吸热反应
参考答案:AC
本题解析:
试题分析:若正反应是吸热反应,升高温度平衡向右移动,因气体总质量守恒,所以若m+n>p+q,则平均相对分子质量增大;若m+n=p+q,则平均相对分子质量不变;若m+n<p+q,则平均相对分子质量减小。若正反应是放热反应,升高温度平衡向左移动,因气体总质量守恒,所以若m+n>p+q,则平均相对分子质量减小;若m+n=p+q,则平均相对分子质量不变;若m+n<p+q,则平均相对分子质量增大。
点评:气体平均相对分子质量= 本题难度:简单 本题难度:简单
4、选择题 已知N2(g)+3H2(g) 2NH3(g)?△H=— 92.4kJ?mo1—1,下列结论正确的是 2NH3(g)?△H=— 92.4kJ?mo1—1,下列结论正确的是
A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4
C.增大压强,平衡向右移动,平衡常数增大
D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60%
参考答案:B
本题解析:
试题分析:A、可逆反应不能进行到底,错误;B、氨气变为液氨放热,正确;C、平衡常数只与温度有关,错误;D、转化率为变化浓度占起始浓度的百分数,N2、H2的变化浓度之比等于1∶3,而起始浓度之比不一定为1∶3,错误。
本题难度:一般
5、选择题 已知强酸与强碱的中和热为57.3kJ/mol,用500mL 0.6mol/L的稀硫酸跟足量的NaOH溶液反应,放出的热量为
A.68.76 kJ
B.57.3 kJ
C.34.38 kJ
D.17.19 kJ
参考答案:C
本题解析:
OH-?? +?? H+? =?? H2O
1mol????? 1mol???? 1mol +57.3KJ
硫酸含有氢离子量为0.6mol,反应如下:
OH-?? +?? H+? =?? H2O
0.6mol?? 0.6mol?? 0.6mol +34.38KJ
本题难度:一般
|