微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:???????????????。
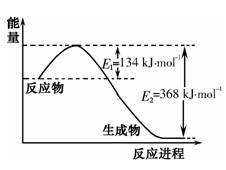
(2)已知: CO(g)+1/2 O2(g)?= CO2(g) ??△H = -283 kJ/mol
N2(g)+ O2(g) ="?" 2 NO(g)??????△H = +180 kJ/mol
则反应2 NO(g)+2 CO(g) N2(g) + 2 CO2(g)? △H =?????????kJ/mol。
N2(g) + 2 CO2(g)? △H =?????????kJ/mol。
(3)在固定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
T/K
| 298
| 398
| 498
|
平衡常数K
| 4.1×106
| K1
| K2
①???????????????写出该反应的平衡常数表达式:K = ????????????????????
②???????????????试判断K1??????K2(填写“>”“=”或“<”)
③下列各项能说明该反应一定达到平衡状态的是???????(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2???? b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变?????????????????????? d.混合气体的密度保持不变
④若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度??????(填增大、不变或减小,下同),NH3的体积分数??????。
参考答案:(1)NO2(g)+CO(g) ==CO2(g)+NO(g)
本题解析:略
本题难度:简单
2、选择题 含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中正确的是(? )
A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=+114.6 kJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=-114.6 kJ/mol
C.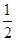 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=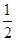 BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol
D.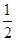 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=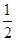 BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol
参考答案:BC
本题解析:强酸与强碱在稀溶液中发生中和反应,每生成1 mol H2O,放出热量57.3 kJ。根据书写热化学方程式的要求判断,B、C符合题意。
本题难度:一般
3、选择题 用如图所示装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是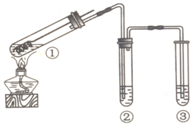
A.上下移动①中铜丝可控制SO2的量
B.为确认CuSO4生成,向①中加水,观察颜色
C.②中选用品红溶液验证SO2的生成
D.③中选用NaOH溶液吸收多余的SO2
参考答案:B
本题解析:分析:A.当铜丝与浓硫酸接触时才能反应;
B.根据溶液颜色的变化判断是否有CuSO4生成;
C.根据SO2的漂白性分析;
D.SO2为酸性气体,可与碱发生反应,
解答:A.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;
B.CuSO4溶液呈蓝色,可依据溶液颜色的变化判断是否有CuSO4生成,故B错误;
C.SO2具有漂白性,可用品红溶液验证SO2的生成,故C正确;
D.SO2为酸性气体,具有污染性,可与碱发生反应,用NaOH溶液吸收多余的SO2,故D正确.
故选B.
点评:本题考查二氧化硫的制备和性质,题目难度不大,注意A项,为制备二氧化硫的简易控制实验方法.
本题难度:一般
4、选择题 分析能量变化示意图,下列选项正确的是( )
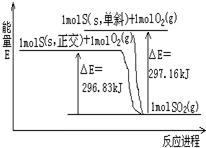
A.S(s,单斜)+O2(g)=SO2(g)△H=+297.16?kJ?mol-1
B.S(s,单斜)+O2(g)=SO2(g)△H=-296.83?kJ?mol-1
C.S(s,正交)+O2(g)=SO2(g)△H=-296.83?kJ?mol-1
D.单斜硫比正交硫更稳定
参考答案:A、依据图象分析单斜硫反应生成二氧化硫是放热反应,反应焓变是
本题解析:
本题难度:简单
5、选择题 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是
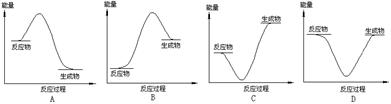
参考答案:A
本题解析:
试题分析:2H2(g)+ O2(g)= 2H2O(g)的放热反应,反应物的能量高,生成物的能量低,多余的能量就释放出来。符合题意的图示为A。
本题难度:一般
|