微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈??????色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是?????。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
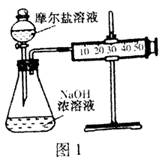
从上图推断甲同学想通过测定???????计算摩尔盐的纯度。该方案的不足之处在于???????????????。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
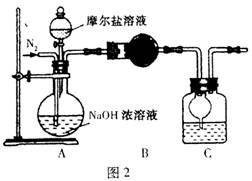
则B与C中的试剂分别是????????????和???????????????。C中干燥管的作用是????????????????????????。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为??????%(答案精确到小数点后第一位)。
参考答案:
(1)浅绿 (2分)
(2)硫酸亚铁(2分)<
本题解析:
试题分析:(1)摩尔盐(NH4)2Fe(SO4)2·6H2O铁的化合价为+2价,水溶液为浅绿色;(2)水溶液中亚铁离子水解,但摩尔盐中铵根离子水解抑制亚铁离子水解,相同浓度的盐溶液其亚铁离子浓度高,反过来c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是硫酸亚铁;(3)摩尔盐中铵根离子与强碱反应生成氨气,实验测定氨气的体积计算摩尔盐的浓度,氨气易溶于水,使产生的氨气不能完全逸出;(4)该实验是通过测定生成氨气的质量测定摩尔盐的纯度,故应先除掉氨气中的水蒸气,再用酸溶液吸收;因为氨
本题难度:一般
2、填空题 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物。反应②、④是工业上的重要反应,部分物质及反应条件没有列出。

?
请回答:
(1) 写出A、B和E的化学式:A??????????????,B??????????????,E??????????????。
(2) 写出C溶液转化为C固体的过程中,HCl气流的作用?????????????????????????????????????。
(3) 写出①、③和④反应的化学反应方程式(若是离子反应的写离子方程式):
①??????????????????????????????????????????????????????
③??????????????????????????????????????????????????????
④??????????????????????????????????????????????????????
参考答案:(1)? A:SiO2,B:MgO,E:MgSiO3?? (
本题解析:由反应②的条件推断是电解法制备金属单质,因为电解氯化物,故C是氯化钠或氯化镁。C溶液蒸干制C固体需在HCl气流中,这是防止水解才采取的方法,故C确定是氯化镁。由此知X中含氧化镁。同时由题意知A应当是一种不能与盐酸反应的氧化物,但A可以与NaOH溶液反应,故第三周期氧化物中符合条件的A只能是二氧化硅。A与B的反应我们虽然没有学过,但是可以从二氧化硅与氧化钙的反应迁移得来。
本题难度:一般
3、填空题 铁是日常生活中用途最广、用量最大的金属材料.
(1)常温下,可用铁质容器盛装浓硫酸的原因是______.
(2)某实验小组利用右图装置验证铁与水蒸气的反应.
①湿棉花的作用是______,试管中反应的化学方程式是______.
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是______(填序号).
a.一定有Fe2+、H+和Fe3+?????????????b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有?H+??????d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体.经测定气体中含有SO2、CO2和H2.
①铁与浓硫酸反应的化学方程式是______.
②气体中混有CO2的原因是(用化学方程式表示)______.
③将672mL(标准状况)收集到的气体通入足量溴水中,反应的离子方程式为______,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66g.由此推知收集到的气体中SO2的体积分数是______.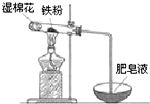
参考答案:(1)常温下,铁在浓硫酸中发生钝化现象使铁表面形成一层致密稳
本题解析:
本题难度:一般
4、选择题 当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的情况是( )
A.有铜无铁
B.有铁无铜
C.有铁有铜
D.无铁无铜
参考答案:B
本题解析:
本题难度:一般
5、填空题 某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
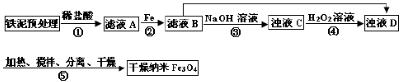 Fe
?
已知:R= ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
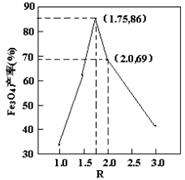
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高
参考答案:(1)2Fe3++Fe=3Fe2+
(2)使亚铁离子沉
本题解析:
试题分析:(1)滤液A中含有Fe3+,加入Fe后发生反应:2Fe3++Fe=3Fe2+
(2)Fe2+在pH=8.3时沉淀完全,所以步骤③中,用NaOH溶液调pH至9,亚铁离子沉淀完全。
(3)浊液C含有Fe(OH)2,加入H2O2,发生氧化还原反应,生成FeOOH,化学方程式为:2Fe(OH)2+H2O2=2FeOOH+2H2O。
(4)a、步骤④中,当反应完成后需再加热一段时间,可除去剩余的H2O2,正确;b、步骤⑤发生的反应为:2FeOOH+Fe2++2OH?=Fe3O4+
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772