微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况(填写金属或金属离子,用化学符号表示)。
(1) 充分反应后,如果Fe有剩余,则容器内不可能有?????????????????;
(2) 充分反应后,如果容器内还有大量Fe3+,不可能有????????????????;
(3) 充分反应后,如果容器内有较多Cu2+和较多的Cu,则容器内不可能有????????。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、填空题 为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4?7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
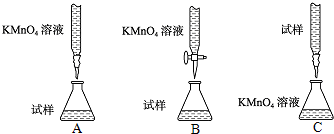
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二?将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
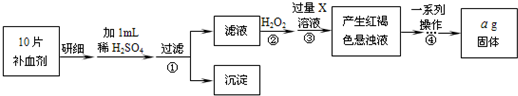
(3)步骤②中除用H2O2外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
参考答案:方案一:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe
本题解析:
本题难度:一般
3、填空题 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
A.纯水
B.NaCl溶液
C.NaOH溶液
D.CuCl2溶液
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_______________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为???????????????????????????????????????????????
参考答案:(1)石墨, 本题解析:
本题解析:
试题分析:(1)b电极连着负极,所以是阳极,得到电子被还原,而铁是被氧化的,所以是石墨,溶液中德氢离子在阳极得到电子被还原;
(2)电解时,当在电极上有白色沉淀生成时,表明溶液中氢氧根离子很多,只能是氢氧化钠溶液;当在两极之间的溶液中有白色沉淀生成时,表明氢氧根离子是在电解过程中产生的,电解质溶液应是氯化钠。
(3)苯的密度比水的密度小,且不溶于水,可以覆盖在溶液的表面,将溶液与空气隔绝,防止空气中的氧气对溶液起到氧化作用,加热可以降低气体在水中的溶解度,从而达到赶尽溶液中氧气的目的;
本题难度:一般
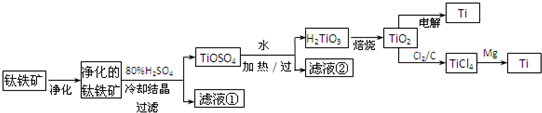
4、填空题 钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TiO2),TiO2常通过两种方法还原可制得Ti.
其中,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.回答下列问题.
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3+H2O和______.
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:
______.
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是______.
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.其阴极反应的电极反应式为______.
(5)因为TiO2?(s)+2Cl2?(g)

TiCl4(l)+O2?(g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
2C(s)+O2(g)=2CO?(g);△H=-221kJ/mol.
TiO2(s)+2C?(s)+2Cl2?(g)?

?TiCl4?(l)+2CO?(g);△H=______.
(6)从化学平衡的角度解释:往TiO2和Cl2反应体系中加入碳后,能使反应TiO2?(s)+2Cl2?(g)

TiCl4(l)+O2?(g)顺利进行的原因是______.
参考答案:(1)钛铁矿含FeO、Al2O3、SiO2等杂质,能与碱反应
本题解析:
本题难度:一般
5、简答题 铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是______(填下列各项序号).
①Fe??????②FeCl3?????③FeSO4
(2)向沸水中逐滴滴加1mol?L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系属于______(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的______(填写序号).
①电泳???????②透过半透膜??????③聚沉??????④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板.请写出FeCl3溶液与铜反应的化学方程式:______;证明反应后的溶液中存在Fe3+的实验方法是______.
参考答案:(1)金属铝可以和氯化铁之间发生氧化还原反应,可以喝硫酸亚铁
本题解析:
本题难度:一般