微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作或装置符合实验目的是( )
A.

用酸性KMnO4溶液滴定Na2SO3
B.
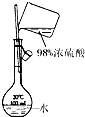
配制稀硫酸溶液
C.
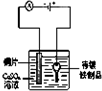
在铁制品上镀铜
D.
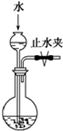
(关闭止水夹)
检查装置气密性
参考答案:A、因KMnO4溶液不能盛放在碱式滴定管中,故A错误;
本题解析:
本题难度:一般
2、选择题 下列叙述中正确的是()
A.构成原电池的正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触时锡先被腐蚀
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
参考答案:D
本题解析:
试题分析:原电池的正负极必须是两种活泼性不同的金属或金属和非金属,A错误;铜、锌原电池,锌比铜活泼,所以锌是负极,B错误;马口铁损坏时,铁比锡活泼,所以铁先腐蚀,C错误。答案选D。
点评:本题非常基础,主要考查原电池的基本概念
本题难度:一般
3、选择题 锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法正确的是
A.钢板中的铁做负极,电极反应为Fe — 2e- ="=" Fe2+
B.放电时正极上有氧气生成
C.放电时OH-向正极移动
D.电池总反应为:2Li+2H2O="==" 2LiOH+H2↑
参考答案:D
本题解析:略
本题难度:一般
4、填空题 (10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为 。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是 ,负极的电板反应式为
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是 (填字母)。
A.只有甲同学
B.甲和乙同学
C.乙和丙同学
D.甲,乙和丙同学
参考答案:(1)Zn+Cu2+=Cu+Zn2+
本题解析:(1)锌比铜活泼,可将铜从其盐溶液中置换出来。
(2)在金属活动顺序表只锌排在氢的前面,铜排在氢的后面,所以锌能和酸反应置换出氢气,而铜不能。
(3)若用导线连接,则构成铜锌原电池,铜是正极,锌是负价,失去电子被氧化。
(4)根据实验现象,3位学生的实验均能达到比较铜和锌的金属活动性相对强弱。
本题难度:一般
5、选择题 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:A
本题解析:
试题分析:金属X和Z用导线连接放入稀硫酸中时,X溶解,说明X是负极,即金属性是X强于Z;电解Y2+和Z2+共存的溶液时,Y先析出,说明Y的金属性弱于Z的;金属性越强,相应阳离子的氧化性越弱,所以根据M2+的氧化性强于Y2+可知,金属性是Y强于M,综上所述,金属性强弱顺序是X>Z >Y>M,答案选A。
考点:考查金属性强弱判断
点评:比较元素金属性强弱的一般依据是:1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强;2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强;3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强;4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属;5.依据金属活动性顺序表(极少数例外);6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强;7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性;8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。
本题难度:一般