微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
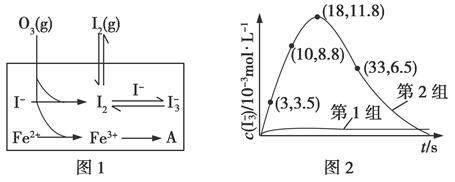
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。
编号
| 反应物
| 反应前pH
| 反应前pH
|
第1组
| O3+I-
| 5.2
| 11.0
|
第2组
| O3+I-+Fe2+
| 5.2
| 4.1
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
参考答案:(1)O3(g)+2I-(aq)+2H+(aq)=O2(g)
本题解析:利用盖斯定律、化学反应速率、化学平衡的影响因素等分析及计算,逐步解决问题。
(1)根据盖斯定律,由①+②+③可得总反应为2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),则ΔH=ΔH1+ΔH2+ΔH3。(2)所给反应的平衡常数表达式为K=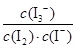 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq) 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq)
本题难度:困难
2、选择题 某温度下,已知反应mX(g)+nY(g)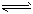 qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是[???? ] qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是[???? ]
A.反应速率v正(X)=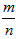 v逆(Y) v逆(Y)
B.加入X,反应的△H增大
C.增加Y的物质的量,X的转化率增大
D.降低温度,平衡向正反应方向移动
参考答案:AC
本题解析:
本题难度:一般
3、填空题 (8分) CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
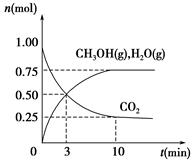
①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1, CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
|