微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW= 。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb= ;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb= ;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb= 。
参考答案:(12分)
KW=10-13
(1)1:10&#
本题解析:
试题分析:解:0,01mol/l的NaOH溶液中C(OH-)=0.01mol/L=10-2mol/L,
pH为11的氢氧化钠溶液中C(H+)=10-11mol/L。
该温度下水的离子积常数Kw=C(H+)*C(OH-)= 10-11mol/L*10-2mol/L=10-13(mol/L)2。
①pH=12的NaOH溶液中C(H+)=10-12mol/L
则氢氧化钠溶液中C(OH-)=Kw/C(H+)=10-13(mol/L)2/10-12mol/L=10-1mol/L
pH=2的硫酸中C(H+)=10-2mol/L,
若所得混合液为中性,则C(H+)*Vb=C(OH-)*Va,
Va:Vb=10-2:10-1=10-2:10-1=1:10。
②所得混合液为中性,则C(H+)*Vb=C(OH-)*Va;且 a+ b= 12,
Va:Vb=C(H+):C(OH-)=C(H+):[Kw/C(H+)]=10-b:10-13+a=1013-a-b=10:1。
③pH=12氢氧化钠溶液中C(OH-)=10-1mol/L,
pH=2的硫酸中C(H+)=10-2mol/L,
pH=10的溶液中C(OH-)=10-13(mol/L)2/10-10mol/L=10-3mol/L,
若所得混合液的pH=10,则说明碱过量,
C(OH-)*Va-C(H+)*Vb=10-1mol/L*Va-10-2mol/L*Vb=(Va+Vb)*10-3mol/L,
解得:Va:Vb=1:9。
考点:酸碱混合计算
点评:
1、强酸、强碱溶液的pH
强酸直接由酸的浓度求出c(H+),强碱先由碱的浓度求出c(OH-),再根据水的离子积换算出c(H+),然后用公式Kw = c(H+)·c(OH—)=1×10-14 pH=" -" lg c(H+)求解
2、两强酸混合抓住氢离子进行计算 2、两强碱混合抓住OH-进行计算,再转化为H+
c (H+) =  c (OH-])=
c (OH-])= 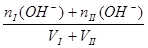
经验规律:(1)两强酸等体积混合 混合后的pH=小的+0.3
(2)两强碱等体积混合 混合后的pH=大的—0.3
3、强酸、强碱混合,酸过量抓住氢离子进行计算、碱过量抓住氢氧根离子进行计算。
(3)酸I+碱II
完全中和:c(H+)= c(OH-) = 1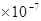 mol/L
mol/L
酸过量: c(H+)=  碱过量:c(OH-)=
碱过量:c(OH-)= 
本题难度:一般
2、填空题 (6分)水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
参考答案:(1)④>②>①>③;(2)④>②&
本题解析:
试题分析:在四种物质的溶液中存在的大量方程式是:①CH3COONH4= CH3COO-+NH4+;②NH4HSO4=NH4++H++SO42-;③NH3.H2O NH4++OH-;④(NH4)2SO4= 2NH4++ SO42-;在①②④中都存在NH4+发生水解反应的而消耗使离子的浓度减小;①CH3COO-对前者其促进作用,使离子浓度进一步减小,②H+对NH4+发生水解反应其抑制作用;所以②>①.根据物料守恒可知④>②,NH3.H2O是若电解质,电离程度是微弱的,所以其离子浓度远小于盐电离产生的离子浓度,因此①>③。故四种溶液中的离子浓度关系的是④>②>①>③;(2)①硫酸是二元强酸,完全电离;③氢氧化钠是一元强碱,完全电离②醋酸是一元弱酸,部分电离,它们产生的离子对水的电离起抑制作用,电离产生的离子浓度越大,对水的电离的抑制作用就越大,所以对水的抑制作用①>③>②,④氯化铵是强酸弱碱盐,电离产生的NH4+发生水解反应消耗水电离产生的OH-,会促进水的电离作用。所以由水电离出的H+浓度由大到小的顺序是④>②>③>①;(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,n(OH-)=0.1mol,c(OH-)=0.1mol/L,则由于中性溶液的pH=6,所以在该温度下的水的离子积产常数是1×10-12,c(H+)=1×10-12÷0.1mol/L=1×10-11,所以充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=11.
NH4++OH-;④(NH4)2SO4= 2NH4++ SO42-;在①②④中都存在NH4+发生水解反应的而消耗使离子的浓度减小;①CH3COO-对前者其促进作用,使离子浓度进一步减小,②H+对NH4+发生水解反应其抑制作用;所以②>①.根据物料守恒可知④>②,NH3.H2O是若电解质,电离程度是微弱的,所以其离子浓度远小于盐电离产生的离子浓度,因此①>③。故四种溶液中的离子浓度关系的是④>②>①>③;(2)①硫酸是二元强酸,完全电离;③氢氧化钠是一元强碱,完全电离②醋酸是一元弱酸,部分电离,它们产生的离子对水的电离起抑制作用,电离产生的离子浓度越大,对水的电离的抑制作用就越大,所以对水的抑制作用①>③>②,④氯化铵是强酸弱碱盐,电离产生的NH4+发生水解反应消耗水电离产生的OH-,会促进水的电离作用。所以由水电离出的H+浓度由大到小的顺序是④>②>③>①;(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,n(OH-)=0.1mol,c(OH-)=0.1mol/L,则由于中性溶液的pH=6,所以在该温度下的水的离子积产常数是1×10-12,c(H+)=1×10-12÷0.1mol/L=1×10-11,所以充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=11.
考点:考查盐的水解、影响水的电离的各种因素;水的离子积常数及溶液的pH的计算的知识。
本题难度:一般
3、选择题 下列在指定溶液中的各组离子,一定能够大量共存的是
A.无色溶液中:HCO3-、Al3+、Cl-、NO3-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+) = 10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+
参考答案:B
本题解析:
试题分析:A、Al3+、HCO3-发生双水解,不能共存,错误;B、pH=11溶液显碱性,OH-跟四种离子大量共存,正确;C、pH=1溶液显酸性,NO3-在酸性条件下,具有强氧化性,能把Fe2+氧化成Fe3+,离子不能大量共存,错误;D、水电离的c(H+)=10-12mol·L-1,抑制了水的电离,溶液可能是酸性或碱性,Fe3+在碱性溶液不能大量共存,错误。
考点:考查离子共存问题。
本题难度:一般
4、选择题 常温下,在pH=12的某碱溶液中,由水电离出的c(OH-)为
[???? ]
A.1.0×10-7 mol/L
B.1.0×10-6 mol/L
C.1.0×10-3 mol/L
D.1.0×10-12 mol/L
参考答案:D
本题解析:
本题难度:一般
5、选择题 水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是
A.1×10-4
B.55.6×107
C.1×107
D.6.02×1021
参考答案:B
本题解析:
本题难度:一般