微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:????????????????????????????????????。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:??????????????????????????????。
③写出步骤(Ⅲ)反应的离子方程式:?????????????????????????????????????。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42-的转化率。
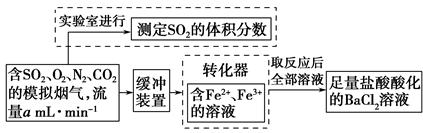
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是???????。(填写序号)

A.碘的淀粉溶液
B.酸性高锰酸钾溶液
C.氢氧化钠溶液
D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO 的转化率,已知气体流速,还需测定的数据有??????????????????、??????????????????????????。
的转化率,已知气体流速,还需测定的数据有??????????????????、??????????????????????????。
参考答案:(1)①SO2+NaOH=NaHSO3
②2NaCl+
本题解析:求解SO2在混合气中的体积分数,需要求出两个量,一个是SO2的体积,一个是混合气的总体积。利用量气装置,可求出吸收SO2后余气的体积;利用洗气瓶中的X溶液,求出SO2的体积。所以对于洗气瓶中的溶液,必须能与SO2反应,且能发生明显的颜色变化,以便确定反应的终点。求解SO2的转化率,应求出SO2气体的总量和生成SO的量。因为在前一问中已求出SO2在混合气中的含量,所以只需确定混合气的总量。利用流速求总量,只需知道通入时间。要求SO2的转化率,只需确定沉淀质量。
本题难度:困难
2、选择题 在一定条件下,下列物质能与硫反应,其中,反应时硫作为还原剂的是
A.Cu
B.O2
C.Fe
D.H2
参考答案:B
本题解析:略
本题难度:简单
3、实验题 (8分)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设 计了如下实验。请回答相关问题。
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用????(填字母),理由是??????;
A.98%浓硫酸???????????????? B.70%硫酸????????????????????? C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如下图所示实验装置,请指出实验装置设计中的不合理之处。
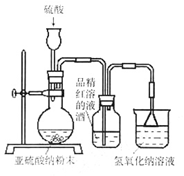
①????????????????????????????????;②???????????????????????????????。
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是?????????。
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3-或SO32-。你认为他的结论是否正确?????,其理由是?????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
4、选择题 常温下,向20L的真空容器中通入amolH2S和bmolCl2(a、b均为正整数,且a≤5,b≤5)。反应完成后,容器内气体可能达到的最大密度是……( )
A.17.85g/L
B.18.00g/L
C.18.25g/L
D.18.50g/L
参考答案:C
本题解析:由反应H2S+Cl2=2HCl+S可知H2S和Cl2物质的量均为5mol,容器内生成10molHCl,密度最大为:(36.5g/mol×10mol)/20L=18.25g/L。
该题容易错选A,认为H2S为1mol、Cl2为5mol,反应后剩余Cl2而密度最大,与SO2、H2S的混合混淆,H2S与SO2反应后生成固体S和液态水,但H2S与Cl2反应后有气体HCl生成,反应特点不同,应注意区分
本题难度:一般
5、选择题 对于下列事实的解释错误的是( )
①蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
②浓硝酸的颜色变黄,说明浓硝酸见光易分解
③SO2气体通入溴水使溴水褪色,说明SO2具有漂白性
④常温下浓硫酸可用铁槽车储运,说明常温下浓硫酸跟铁不反应.
A.①②③④
B.③④
C.只有③
D.只有④
参考答案:B
本题解析:
试题分析:SO2具有还原性,能被溴水氧化,③不正确;常温下铁和浓硫酸发生钝化,钝化是化学变化,④不正确,其余选项是正确的,答案选B。
点评:该题是常识性知识的考查,试题基础性强,有利于调动学生的学习兴趣和学习积极性。该题的关键是熟练记住浓硫酸和硝酸的性质,然后灵活运用即可,难度不大。
本题难度:一般