微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 实验室需要0.1mol /L氢氧化钠溶液100mL,现有2mol /L氢氧化钠溶液。
(1)这100ml的溶液中含有的溶质的物质的量是????mol(2分);质量是??????g(2分)
(2)所需2mol /L氢氧化钠溶液的体积为_____mL;(3分)
(3)完全中和50 mL已配制溶液,需要1mol/L的盐酸_____mL。(3分)
参考答案:(1)0.01 ;?? 0.4?????(2)5??(3)5
本题解析:(1)根据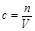 可知,氢氧化钠的物质的量是0.1mol /L×0.1L=0.01mol,质量是m=0.01mol×40g/mol=1.4g。
可知,氢氧化钠的物质的量是0.1mol /L×0.1L=0.01mol,质量是m=0.01mol×40g/mol=1.4g。
(2)由于在稀释过程中溶质的质量是不变的,所以所需2mol /L氢氧化钠溶液的体积为 本题难度:一般
本题难度:一般
2、选择题 配制一定物质的量浓度的稀盐酸时,最后用胶头滴管向容量瓶滴加蒸馏水,由于不慎,液面超过了容量瓶颈上的刻度,这时应采取的措施是(???)
A.用胶头滴管吸出超过的那一部分
B.把溶液倒出一部分在蒸发皿中,蒸发一部分水后把蒸发皿中剩余的溶液仍注入容量瓶,重新加水至刻度
C.根据超出的蒸馏水量,经过计算,补加浓盐酸
D.把容量瓶中的溶液全部弃去,重新配制。
参考答案:D
本题解析:
试题分析:液面超过了容量瓶颈上的刻度,这时应采取的措施是把容量瓶中的溶液全部弃去,重新配制,答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查。该题的关键是明确物质的量浓度溶液配制的原理、操作注意事项,然后灵活运用即可,有利于培养学生的规范严谨的实验设计能力和动手操作能力。
本题难度:一般
3、选择题 同质量的下列气体中,所含原子数最少的是( )
A.CH4
B.CO2
C.H2S
D.N2
参考答案:B
本题解析:
本题难度:一般
4、选择题 在50mL bmol·L-1的AlCl3溶液中加入50mL amol·L-1 NaOH溶液。
(1)当a、b满足_____________________条件时,无沉淀产生。
(2)当a、b满足_____________________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为_____________________克。
参考答案:(1)a≥4b (2)3b<a<4b;
本题解析:
试题分析:在AlCl3溶液中加入NaOH溶液时首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl 。产生白色沉淀;当NaOH过量时发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O 。沉淀又溶解。由方程式可看出n(OH-)<3n(Al3+)时,有白色沉淀,当n(OH-)=3n(Al3+)时,沉淀达到最大值。当4n(Al3+)>n(OH-)>3n(Al3+)时,沉淀逐渐溶解。当n(OH-)≥4n(Al3+)时,沉淀完全溶解。由于AlCl3溶液与NaOH溶液的体积相同,所以二者的浓度比就是二者的物质的量的比。(1)当a、b满足 a≥4b条件时,无沉淀产生。(2)当沉淀达到最大值时, n(Al(OH)3)=n(Al3+)=0.05mol.m(Al(OH)3)= 0.05mol×78g/mol=3.9g.当a、b满足3b<a<4b时,先有沉淀生成,后又有部分沉淀溶解,根据方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知1mol的NaOH溶解1mol的Al(OH)3。所以此时Al(OH)3的质量为3.9(4b-a)g.
考点:考查AlCl3溶液与NaOH溶液反应产生的沉淀的质量关系的知识。
本题难度:一般
5、选择题 上海磁悬浮铁路是世界上第一条投入运营的商业磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量分别为
A.0.50、0.50、0.50
B.0.50、1.0、1.5
C.0.25、1.0、1.5
D.1.0、0.25、0.17
参考答案:C
本题解析:
试题分析:根据质量守恒定律,可以得到Y2O3、BaCO3和CuO的物质的量分别为0.25、1.0、1.5。故选C。
点评:本题重点考查的是质量守恒定律在物质的量计算中的应用,题目难度不大,注意基础知识的学习。
本题难度:一般