微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水稀释0.5mol?L-1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是( )
①H+的物质的量
②C(H+)
③C(H+)/C(CH3COO-)
④C(CH3COOH)/C(CH3COO-)
⑤C(OH-)
A.①③⑤
B.①④⑤
C.②④
D.③④
参考答案:醋酸(CH3COOH)溶液中醋酸是弱电解质存在电离平衡,CH
本题解析:
本题难度:简单
2、选择题 常温下将0.1 mol/L甲酸(HCOOH)溶液加水稀释, 下列说法正确的是?
[???? ]
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)/c(HCOOH)减小
C.HCOO-离子的数目增大
D.溶液的pH减小
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知室温时,0.1mol/L 某一元酸HA 在水中有0.1% 发生电离,下列叙述错误的是[???? ]
A.该溶液的pH=4????????????????
B.此酸的电离平衡常数约为1 ×10-7
C.升高温度,溶液的pH 增大????
D.由HA 电离出的c(H+) 约为水电离出的c(H+) 的106倍
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列事实一定能说明HNO2为弱电解质的是
①常温下Na NO2溶液的PH>7?②10mL1mol/L HNO2恰好与10mL1mol/LNaOH完全反应③HNO2与NaCl不能反应④0.1mol/L HNO2溶液的PH=2.1
A:①②③④???? B:②③④???? C:①④??? D:②④
参考答案:C
本题解析:略
本题难度:一般
5、选择题 下列说法正确的是

A.某反应的反应过程中能量变化如图所示,由上图分析可知催化剂不改变反应的焓变
B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.已知: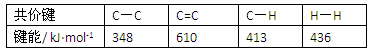 则可以计算出反应
则可以计算出反应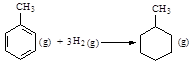 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
D.常温下在0.10 mol·L-1的氨水中加入少量NH4Cl晶体,NH3·H2O的电离程度和溶液的pH均减小
参考答案:AD
本题解析:
试题分析:A.由于催化剂能够降低反应的活化能但是不变改变反应物与生成物的能力差,及不能改变焓变,正确;B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快,反应原理也会发生改变,Na与O2反应生成Na2O2,错误;C.由于在苯环内含有的化学键不是碳碳单键与碳碳双键的交替结构,而是介于单键和双键之间的一种独特的化学键,所以根据表格的键能大小不能确定该反应的反应热,错误;D. 在氨水中存在电离平衡:NH3·H2O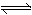 NH4++OH-;若向氨水中加入少量NH4Cl晶体,平衡逆向移动,NH3·H2O的电离程度减小,由于c(OH-)减小,所以溶液的pH也减小,正确。
NH4++OH-;若向氨水中加入少量NH4Cl晶体,平衡逆向移动,NH3·H2O的电离程度减小,由于c(OH-)减小,所以溶液的pH也减小,正确。
考点:考查反应热与焓变和键能的关系、温度对反应速率反应原理的影响、微粒浓度对弱电解质电离平衡的影响的知识。
本题难度:一般