微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数不变,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
参考答案:A.增大压强,单位体积活化分子的数目增大,活化分子的百分数不
本题解析:
本题难度:一般
2、填空题 下表是稀硫酸与某金属反应的实验数据:
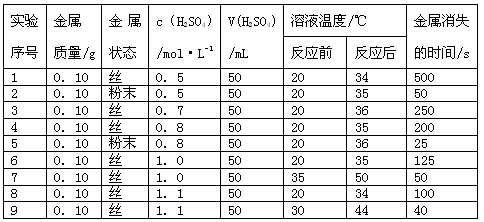
分析上述数据,回答下列问题:
(1)实验4和5表明,________对反应速率有影响,________ 反应速率越快,能表明同一规律的实验还有_________(填实验序号
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号,填一组即可)。
(3)本实验中影响反应速率的其他因素还有________ ,其实验序号是_________。(填一组即可)
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: ___________________________________。
参考答案:(1)固体反应物的表面积;表面积越大;1、2
(2)
本题解析:
本题难度:一般
3、选择题 下列反应中产生气泡速率最快的是
?
| 温度
| 浓度
| 催化剂
|
A
| 25℃
| 2mL5%H2O2
| 0.1mol/LFeCl32滴
|
B
| 35℃
| 2mL8%H2O2
| MnO2粉末
|
C
| 25℃
| 2mL5%H2O2
| MnO2粉末
|
D
| 25℃
| 2mL8%H2O2
| 0.1mol/LCuCl22滴
?
参考答案:B
本题解析:
试题分析:
影响化学反应速率的因素有浓度、温度、催化剂等,其中催化剂影响最大,且二氧化锰的催化效果优于FeCl3和CuCl2;其次为温度,最后影响为浓度,综合得到,本题答案为B。
本题难度:一般
4、选择题 下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C.Fe与稀硫酸反应制取氢气时,改用浓硫酸
D.用碳还原Fe2O3冶炼铁时,增大碳的用量
参考答案:A、因水为纯液体,则改变水的量对反应速率无影响,故A错误;<
本题解析:
本题难度:一般
5、填空题 “碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃下进行实验,得到 的数据如下表:
实验编号
| ①
| ②
| ③
| ④
| ⑤
| c(I-)/mol·L-1
| 0.040
| 0.080
| 0.080
| 0.160
| 0.120
| c(S2O82-)/mol·L-1
| 0.040
| 0.040
| 0.080
| 0.020
| 0.040
| t/s
| 88.0
| 44.0
| 22.0
| 44.0
| t1
回答下列问题:
(1)该实验的目的是_____________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s???? B.22.0~44.0 s
C.>44.0 s???? D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________
________________________________________________________________________。
参考答案:(1)研究化学反应速率和反应物浓度的关系?(2)29.3??
本题解析:
试题分析:(1)根据表中数据可分析出c(I-)、c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响,即该实验的目的研究化学反应速率和反应物浓度的关系。
(2)对比数据组①和②,可以看到,c(S2O82-)不变,c(I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;对比数据组②和③,可以看到,c(I-)不变,c(S2O82-)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;对比数据组③和④,可以看
本题难度:简单
|
|