微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (三选一)【化学与技术】
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。 ??
I.工业上有多种方法来制备氮化硅,常见的方法有:???
①方法一??直接氮化法:在1300~1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为__________________________。???
②方法二??化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是__________________???
③方法三??Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体__________??(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为_________。 ??
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
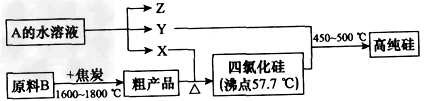
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)原料B的主要成分是_____________(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:_____________________。
(3)上述生产流程中电解A的水溶液时,____(填“能”或 “不能”)用Cu作为阳极材料;写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极方程式:
阳极:__________________;阴极:___________________。
参考答案:I.①3Si+2N2![]() 本题解析:
本题解析:
本题难度:一般
2、填空题 Li2MSiO4(M=Mn、Fe、Co等)是极具发展前景的新型锂离子电池的电极材料,下面列出了两种制备
Li2FeSiO4的方法。同相法:2Li2SiO3+FeSO4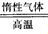 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
溶胶一凝胶法: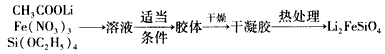
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是___________________。
(2)溶胶一凝胶法中,检验溶液中有胶体产生的方法是_________________实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的数目为__________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4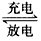 Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
(4)Li2MSiO4的性能对比如下图所示。实际应用时,常用含有来源丰富的铁元素的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是______________。
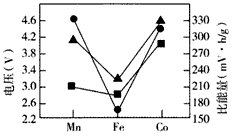
▲Li2MSiO4充电时脱去Li+所需电压 ●Li2MSiO4放电时的理论电压 ●Li2MSiO4放电时的理论比能量
参考答案:(1)防止+2价铁被氧化
(2)取少量液体,用一束强
本题解析:
本题难度:一般
3、选择题 我国实施的重大工程“西气东输”中所说的“气”指的是[???? ]
A.天然气
B.液化石油气
C.水煤气
D.氨气
参考答案:A
本题解析:
本题难度:简单
4、填空题 有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。而钯是一种贵金属,对其回收再利用显得极为重要。一种由废催化剂制取PdCl2的工艺流程如下
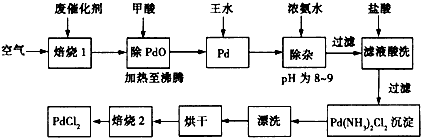
(1)“焙烧1”通入空气的目的是__________________。
(2)甲酸在反应中被氧化为二氧化碳,写出并配平甲酸与PdO反应的化学方程式__________________。
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是__________。
(4)Pd中加入王水(浓硝酸与浓盐酸的混合物)的反应可以表示为Pd +HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。通过计算判断物质A的化学式_______________。
(5)写出“焙烧2”发生反应的化学方程式________________________。
参考答案:(1)使有机化合物等可燃物通过燃烧而除掉
(2)HCO
本题解析:
本题难度:一般
5、填空题 二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下
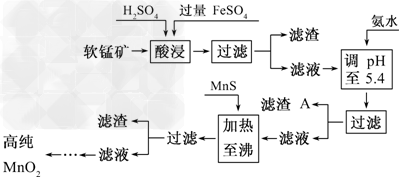
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)?等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题

(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
参考答案:(1)MnO2+2FeSO4+2H2SO4==MnSO4+F
本题解析:
本题难度:一般