微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某校化学研究性学习小组学习了化学反应与能量的内容后,对CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3块状固体放入1L、1mol?L-1稀盐酸中,记录下了随反应时间的变化生成CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略不计,请分析以下问题:
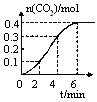
(1)若想加快该反应的速率,可以采取的措施是 、 (答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为 ,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是 。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况 ;呈现这种变化的原因是 。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为 。
参考答案:(1)升高温度、将块状固体碾成粉末、适当增加盐酸浓度等(2)
本题解析:
试题分析:(1)若想加快该反应的速率,可以采取的措施是升高温度、将块状固体碾成粉末、适当增加盐酸浓度等。(2)反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑由方程式物质间的关系可知,每产生1mol CO2,会消耗2mol的HCl。 图像可以看出:在0~2min内,用HCl浓度变化表示的平均反应速率为(0.2mol÷1L)÷2min=0.1mol/(L·min)。在2~4 min内V(HCl)=(0.4mol÷1L)÷2min=0.2mol/(L·min)。在2~4 min内V(HCl)=(0.2mol÷1L)÷2min=0.1mol/(L·min)。所以在2~4 min内反应速率最大。(3)反应CaCO3+2HCl=CaCl2+H2O+CO2↑是放热反应,在反应开始时,在0~2min内温度较低,反应慢,随着反应进行,放出的热量使反应体系温度升高,2~4 min内加快,之后,由于反应物盐酸浓度下降,因此在4~6 min内又变慢。故反应在0~2 min内较慢,2~4 min内加快,4~6 min内又变慢。(4)根据图像中曲线的变化趋势,结合前边的计算可以看出,第8min时,c(HCl)=0.所以该反应的反应速率为0 mol /(L·min)。
考点:考查影响化学反应速率的因素及CaCO3与HCl反应速率变化的原因的知识。
本题难度:一般
2、选择题 对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)  2C(g) ?H <0,下列叙述错误的是
2C(g) ?H <0,下列叙述错误的是
A.升高温度v(正)、v(逆)都增大,但v(逆)增的更大
B.增大压强v(正)、v(逆)都增大,但v(正)增的更大
C.增大A的浓度v(正)会增大,但v(逆)会减小
D.采用正的催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同
参考答案:C
本题解析:根据方程式可知,正反应是放热反应,所以升高温度,正逆反应速率都是增大的,但逆反应速率增大的更大,平衡向逆反应方向移动,A正确;正反应是体积减小的可逆反应,所以增大压强,正逆反应速率都是增大的,但正反应速率增大的更大,平衡向正反应方向移动,B正确;增大反应物的浓度,正反应速率突然增大,而逆反应速率逐渐增大,平衡向正反应方向移动,C不正确;催化剂是同等程度改变正逆反应速率,选项D正确,答案选C。
本题难度:一般
3、选择题 在2A+B  ?3C+4D反应中,表示该反应速率最快的是???????? (???? )
?3C+4D反应中,表示该反应速率最快的是???????? (???? )
A.v(A)=5 mol·L-1·min-1???? B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1???? D.v(D)=10 mol·L-1·min-1
参考答案:B
本题解析:比较同一化学反应方程式的反应速率快慢的方法为转化为同一种物质的反应速率;依据同一化学反应方程式中化学反应速率比=化学计量数比可得;
当A选项中v(A)=5 mol·L-1·min-1时v(B)=0.5 mol·L-1·min-1;小于B选项的反应速率;当D选项中v(D)=10 mol·L-1·min-1时v(B)=2.5 mol·L-1·min-1,小于B选项的反应速率;当v(C)=0.8 mol·L-1·s-1时v(B)= 本题难度:简单
本题难度:简单
4、选择题 下列过程中,需要加快化学反应速率的是
A.食物腐烂
B.金属生锈
C.温室效应
D.工业上合成氨
参考答案:D
本题解析:略
本题难度:简单
5、选择题 反应2A(g)
参考答案:
本题解析:
本题难度:一般