微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度②加入催化剂③增大反应物浓度④将块状固体反应物磨成粉末.
A.①②③
B.①②④
C.①③④
D.①②③④
参考答案:①升高温度、②加入催化剂可增大活化分子的百分数,反应速率增大
本题解析:
本题难度:简单
2、选择题 将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是[???? ]
A.盐酸浓度不变,用量增大一倍
B.盐酸浓度增加一倍,用量减到1/2
C.增大碳酸钠粉末的用量
D.使反应在较低温度下进行
参考答案:B
本题解析:
本题难度:一般
3、选择题 在温度和容积不变的容器中,一定条件下发生下列变化:H2(g) 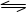 2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
A.12秒
B.无法判断
C.大于12秒
D.小于12秒
参考答案:C
本题解析:
试题分析:H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么化学反应速率为(0.1-0.06)/20=0.002mol/(L?s),若化学反应速率不变,H2的浓度由0.06mol/L下降到0.036mol/l时需时间为t,则0.002mol/(L?s)=(0.06-0.036)/t,解得t=12秒,实际上,化学反应速率会越来越慢,所以大于12秒。
考点:考查化学反应速率的计算。
本题难度:一般
4、选择题 反应4A(g)+5B(s)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s)?????????B.v(A)= 0.030mol/(L ·s)?
C.v(C)=0.040mol/(L· s)?????????D.v(D)=0.090mol/(L· s)
参考答案:D
本题解析:
试题分析:在0.5L密闭容器中进行,30s内A减少了0.90mol,则用物质A表示的反应速率是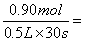 0.060mol/(L ·s),C不正确。又因为反应速率之比是相应的化学计量数之比,所以物质CD的反应速率分别是0.060mol/(L ·s)、0.090mol/(L· s),C不正确,D正确。物质B是固态,不
0.060mol/(L ·s),C不正确。又因为反应速率之比是相应的化学计量数之比,所以物质CD的反应速率分别是0.060mol/(L ·s)、0.090mol/(L· s),C不正确,D正确。物质B是固态,不
本题难度:简单
5、选择题 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是 [???? ]
A.盐酸的浓度
B.铝条的表面积
C.溶液的温度
D.加少量Na2SO4
参考答案:D
本题解析:
本题难度:一般
[-page-来源:91考试网 91ExAm.org]
1、选择题 在一定条件,把3molA和2.5molB混合于2L的密闭容器中,发生反应的化学方程式为:3A(g)+B(g)?xC(g)+2D(g),5min后反应达到平衡,容器内的压强变小,已知D的平均反应速率为0.1mol/(L?min).下列结论错误的是( )
A.A的平均反应速率是0.15mol?L-1?min-1
B.平衡时C的浓度为0.125mol/L
C.平衡时B的转化率为20%
D.x=1
2、选择题 把0.6 mol X气体和0.4 mol Y气体混合于1L容器中使它们发生如下反应,3X(g)+Y(g) ?nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
?nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
A.1
B.2
C.3
D.4
3、选择题 为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为不正确的是( )
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
4、填空题 (19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2=-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=" -92.2" kJ·mol-1
2NH3(g);ΔH=" -92.2" kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
 时间(h) 时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0.00
| 0.20
| n2
| 1.00
| 1.00
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
5、实验题 (14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
| 粉末状
| 混合不振荡
| 剧烈反应,使木条复燃
| 3.5分钟
| 块状
|
| 反应较慢,火星红亮但木条未复燃
| 30分钟
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
| 操作情况
| 反应完成所需的时间
| 收集到气体体积
| 反应后液体温度
| a1%的150mL
|
| 11分钟
| 539mL
| 24℃
| a2%的15mL
| 混合不振荡
| 1分20秒
| 553mL
| 56℃
| a3%的7.5mL
|
| 9秒
| 562mL
| 67℃
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772