微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 化学在能源开发与利用中起着十分重要的作用.
(1)蕴藏在海底的“可燃冰”是高压下形成的外观酷似冰的甲烷水合物.我国南海海底有丰富的“可燃冰”资源.取365g分子式为CH4?9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成CO2和H2O(l),可放出1780.6kJ的热量,则甲烷燃烧的热化学方程式为______.

(2)甲醇是重要的基础化工原料,又是一种新型的燃料,制取甲醇的传统方法是采用CuO-ZnO/γ-Al2O3为催化剂,合成反应为:CO+2H2
催化剂
.
加热加压
CH3OH.生产中一些工艺参数如图所示.该反应为______(填“吸热”或“放热”)反应.说明你作出判断的依据______.
最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为______.电池工作时,固体电解质里的O2-向______极推动.
参考答案:(1)365g中甲烷的物质的量为
本题解析:
本题难度:一般
2、填空题 (3分)发射卫星用 作燃料, 作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知: 作氧化剂,两者反应生成N2和水蒸气,已知:
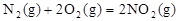 △H1=+67.7kJ/mol △H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式
。
参考答案:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g
本题解析:考查盖斯定律的应用。根据盖斯定律可知,②×2-①即得到
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),所以△H=-534kJ/mol×2-67.7kJ/mol=-1135.7kJ/mol。
本题难度:一般
3、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
周期
| ⅠA
|
| 0
| 1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
| 2
|
|
|
| ②
| ③
| ④
|
|
| 3
| ⑤
|
| ⑥
|
|
| ⑦
| ⑧
|
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: 。
参考答案: 本题解析: 本题解析:
试题分析:(1)⑥元素为第三周期第三主族元素铝,原子序数为13,其离子结构示意图为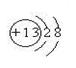
(2)元素⑦为S元素,质子数和中子数相等,则质量数是32,其同位素符号是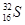 (或32S), (或32S),
(3)④、⑤、⑦的离子分别是O2-、Na+、S2-,根据半径的大小主要由电子层数、核电荷数决定,电子层数越多半径越大,核电荷数越多半径越小,所以3种离子的半径大小顺序为S2->O2-> Na+,
(4)②为碳元素,最高价氧化物对应水化物为碳酸,属于弱酸,其电离方程式为:H2CO3? HCO3- + H+ HCO3- ? CO32- + H+,
(5)④、⑤两种元素分别为氧、钠元素,原子按1:1组成的化合物为Na2O2,其电子式为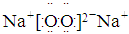
(6)由表中两种元素形成的5核10电子分子应是CH4,该电池在碱性条件下的负极反应式为:CH4-8e-+10OH-= CO32-+7H2O
(7)A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料,则A为N2H4, B是一种常见强氧化剂,则B为H2O2, 根据所给数据可得A与B反应的热化学方程式:N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g) ΔH="-1676" kJ/mol
考点:考查元素周期表与原子结构、化学键、电离、化学反应与能量、燃料电池等相关知识的综合应用。同时考查学生分析问题解决问题的能力
本题难度:困难
4、选择题 已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56. 0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是[???? ]
A. 2CO(g)+O2(g)=2CO2(g) △H=+282.8kJ/mol
B. 2H2(g)+O2(g)=2H2O(g) △H=-571.6kJ/mol
C. C(石墨,s)+1/2O2(g)=CO(g) △H=-110.7kJ
D. 燃烧前混合气体中,H2的体积分数为40%
参考答案:D
本题解析:
本题难度:一般
5、填空题 (1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水蒸气。已知室温下1g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是____。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个热化学方程式____。
参考答案:(1)SiH4(g)+2O2(g)=SiO2(s)+2H2O
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772