微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_____________________________。
(2)根据如下反应式:
A.Na+(g)+Cl-(g)→NaCl(s);△H
B.Na(s)+1/2Cl2(g)→NaCl(s);△H1
C.Na(s)→Na(g);△H2
D.Na(g)-e-→Na+(g);△H3
E.1/2Cl2(g)→Cl(g);△H4
F.Cl(g)+e-→Cl-(g);△H5
写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式__________________________
(3)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
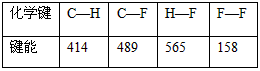
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)==CF4(g)+4HF(g) △H=______________________
2、选择题 肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-1059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-1076.7 kJ/mol
D.N2H4(g)+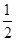 N2O4(g)===
N2O4(g)===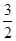 N2(g)+2H2O(g)ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g)ΔH=-1076.7 kJ/mol
3、填空题 (1) 在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离为 ,此温度CH3COOH的电离平衡常数为 。
(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7。则H2A在水溶液中的电离方程式为 ,该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH= 。
(3) 已知HCN(aq)+NaOH(aq)=NaCN(aq)+ H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq) +NaOH(aq)=NaCl(aq) + H2O(l) ΔH=-57.3 kJ·mol-1。
则在水溶液中HCN H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1
4、简答题 能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(1)已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.请写出甲醇燃烧的热化学方程式.______
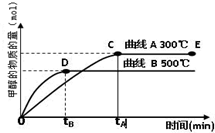
(2)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)?
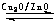
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
①合成甲醇反应的△H______0.(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率______.(填“加快”、“减慢”、“不变”),重新平衡时c(CH3OH)/c(CO)______.(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1.若其它条件不变,将温度升高到450℃时,达到平衡时,K______1?(填“>、<或=”)
(3)、下列有关甲醇的说法正确的是______
A.甲醇能使蛋白质变性????????????????B.甲醇能发生消去反应
C.甲醇不能被催化氧化????????????????????D.甲醇与钠反应比水与钠反应剧烈
(4)利用甲醇燃料电池设计如图所示的装置:则该装置中Zn极为______极;写出a极的电极反应式______.
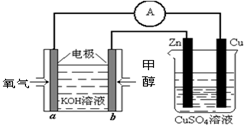
5、填空题 (15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯
B.长直玻璃导管
C.锥形瓶
D.直型冷凝管
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。