微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式中,正确的是[???? ]
A.NaHCO3=Na++H++CO32-
B.NaHSO4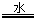 Na++HSO4-
Na++HSO4-
C.H2SO4=2H++SO42-
D.KClO3=K++Cl-+3O2-
参考答案:C
本题解析:
本题难度:简单
2、选择题 室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
参考答案:C
本题解析:
试题分析:A.当x=0.2,则混合后二者恰好完全反应产生NaHA。若NaHA是强酸的酸式盐或是弱酸的酸式盐,HA-的电离大于其水解作用,则溶液显酸性,y小于7,若NaHA是弱酸的酸式盐,HA-的水解大于其电离作用,则溶液显碱性,y大于7,正确;B.当x=0.2,y=1,反应产生NaHA ,c(NaHA)=0.1mol/L。由于y=1,即c(H+)=0.1mol/L,NaHA是强酸的酸式盐,则根据物料守恒可得混合溶液中:c(H+)= c(A-) +c(OH-),正确;C.当x=0.3,则反应产生的是NaHA、Na2A等浓度的混合溶液。y>7,则混合溶液中离子浓度关系是c(Na+) >c(HA-)>c(A2-)> c(OH-)>c(H+),错误;D。当x=0.4,反应反应产生Na2A。则根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+ c(HA-)+ 2c(A2-)。全部大于部分的和,因此混合溶液中:[c(Na+)+ c(H+)]>2c(A2-),正确。
考点:考查酸碱混合溶液中离子的浓度大小比较的知识。
本题难度:一般
3、选择题 下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为
A.0
参考答案:
本题解析:
本题难度:一般
4、选择题 给蒸馏水中滴入少量盐酸后,下列说法中错误的是
A.[H+][OH-]乘积不变
B.pH增大了
C.[OH-]降低了
D.水电离出的[H+]增加了
参考答案:B
本题解析:
本题难度:困难
5、填空题 写出下列物质的电离方程式。
H2SO3______________________________,
NaHSO4(稀溶液)______________________________,
NaHSO4(熔融)______________________________。
参考答案:H2SO3=H++HSO3-;HSO3-=H++SO32-;
本题解析:
本题难度:一般