微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水是极弱的电解质,改变外界条件对水的电离有促进或抑制作用,下列说法错误的是 [???? ]
A.在蒸馏水中加入强酸或强碱对水的电离均有抑制作用;增加水的量,促进水的电离
B.在蒸馏水中加入盐对水的电离可能有抑制作用,也可能有促进作用
C.压强对水的电离影响较小,升高温度对水的电离有促进作用
D.pH=4的某电解质溶液,其溶质可能是酸或者盐
参考答案:A
本题解析:
本题难度:一般
2、选择题 用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)和c(H+)
D.c(H+)和c(OH-)的乘积
参考答案:B
本题解析:加水促进NH3·H2O的电离,使n(NH3·H2O)减小,n(OH-)增大,c(OH-)减小,但c(H+)和c(OH-)的乘积即KW不变,则c(H+)增大。因此c(NH3·H2O)/c(OH-)=n(NH3·H2O)/n(OH-)减小。
本题难度:一般
3、选择题 下列的图示与对应的传述相符的是
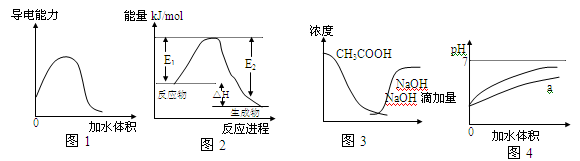
A.图1表示稀释冰醋酸过程中溶液导电性的变化曲线
B.图2表示某一放热反应,若使用催化剂E1、E2,△H都会发生改变
C.图3曲线表示将氢氧化钠滴加到醋酸溶液浓度的变化趋势
D.图4表示pH相同的盐酸与醋酸分别加入水中后溶液pH的变化,其中曲线a对应的是盐酸
参考答案:C
本题解析:
试题分析:A、冰醋酸在没有加水之前,不电离,因此不导电,图像不正确,A错误;B、催化剂只能改变活化能,但不能改变焓变,图像不正确,B错误;C、向醋酸溶液中滴加氢氧化钠溶液,醋酸被中和,醋酸浓度减小,完全反应后氢氧化钠的浓度又逐渐增大,图像正确,C正确;D、醋酸是弱酸,存在电离平衡,盐酸是强酸,完全电离。在pH相等的条件下稀释相同的倍数盐酸溶液的pH变化大,则a曲线表示醋酸,D错误,答案选C。
考点:考查弱电解质的电离、催化剂酸碱中和等有关图像判断
本题难度:一般
4、选择题 常温下,将pH=4的盐酸溶液与pH=10的NaOH溶液等体积混合,混合溶液的pH是
A.等于7
B.大于7
C.小于7
D.无法判断
参考答案:A
本题解析:pH和等于14 的酸碱混合问题,混合溶液的酸碱性决定于酸碱的强弱,谁弱谁过量一般显谁性。
本题难度:一般
5、填空题 (6分) (1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
参考答案:(1) c(OH-)= 1×10_11mol/L
本题解析:(1)pH=3,则OH-浓度是10-14÷0.001=10-11mol/L。
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是弱酸,氢氧化钠是强碱,所以氢离子浓度由小到大的顺序是③<④<①<②。
(3)醋酸根水解显碱性,NH4+水解显酸性,所以二者相互促进。同样碳酸根也促进NH4+水解。亚铁离子水解显酸性,抑制NH4+水解,所以溶液中c(NH4+)由大到小的顺序为③>①>⑤>④>②。
(4)氨水是弱碱,其浓度大于0.001mol/L,所以氨水过量,溶液显碱性。根据电荷守恒可知(4)c(NH4+)>c(Cl-)。
本题难度:一般