微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)???△H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键???? b. 共价键???? c. 配位键??? d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4????? b. CH4????? c. NH4+???? d. H2O
参考答案:(1)2s22p3?????(2)N>O>C
(3)
本题解析:(1)根据构造原理可写出基态氮原子的价电子排布式是2s22p3。
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。②根据反应式可知,当反
本题难度:一般
2、选择题 下列分子的电子式书写正确的是[???? ]
A.氨气 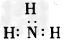
B.四氯化碳 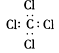
C.氮气 
D.二氧化碳 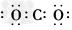
参考答案:C
本题解析:
本题难度:简单
3、填空题 (5分)用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子
| 孤对电子对数
| VSEPR模型名称
| 中心原子杂化轨道类型
| 分子或离子的立体构型名称
|
CH4
| 0
| 正四面体形
| sp3
| 正四面体形
|
BeCl2
| ?
| ?
| ?
| ?
|
SO2
| ?
| ?
| ?
| ?
|
CH3+
| ?
| ?
| ?
| ?
|
SO42-
| ?
| ?
| ?
| ?
|
NCl3
| ?
| ?
| ?
| ?
参考答案:(5分)
分子或离子
孤对电子对数
VSE
本题解析:根据价层电子对互斥理论可知,甲烷知碳原子含有的孤对电子对数是(4-1×4)÷2=0,所以甲烷分子的构型是正四面体形,其中碳原子是sp3杂化。BeCl2中Be原子含有的孤对电子对数是(2-1×2)÷2=0,因此是直线型结构,属于sp杂化。SO2中硫原子含有的孤对电子对数是(6-2×2)÷2=1,则SO2是V形结构,是sp2杂化。CH3+中碳原子含有的孤对电子对数是(4―1―1×3)÷2=0,因此是平面三角形结构,属于sp2杂化。SO42-中硫原子含有的孤对电子对数是(6+2-2×4)÷2=0,所以是正四面体
本题难度:一般
4、选择题 下列叙述中正确的是[???? ]
A.在极性分子中不可能存在非极性键
B.在离子晶体中不可能存在极性键
C.在原子晶体中可能存在离子键
D.含有共价键的晶体可能是离子晶体
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列各组物质中,化学键类型完全相同的是[???? ]
A.Cl2和CCl4??
B.HI和NaI
C.H2S和CO2??
D.F2和NaBr
参考答案:C
本题解析:
本题难度:简单
|