微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:?Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
参考答案:AC
本题解析:
试题分析:银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答。A、负极发生Zn+2OH--2e-=ZnO+H2O,c(OH-)减小,所以电池负极区溶液的pH减小,故A正确;B、Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag2O极,故B错误;C、Zn失去电子,Zn为负极,Ag2O得到电子是
本题难度:一般
2、选择题 下列有关锌锰干电池的说法中正确的是( )
A.锌外壳是负极,石墨碳棒是正极材料
B.在外电路中电子从碳棒流向锌外壳
C.电流从锌流到碳棒上
D.在电池内部阳离子从碳棒向锌片移动
参考答案:A、阳极原电池原理分析,失电子的做负极,在正极上得到电子发生
本题解析:
本题难度:简单
3、选择题 电池是应用广泛的能源。
(1)设计两种类型的原电池,比较其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见右图),并作相应标注。
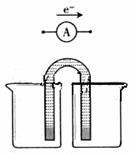
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙。
③甲、乙两种原电池中乙的能量转化效率较低,其原因是????????。
(2)Al-AgO电池可作用水下动力电源,其原理如图所示。其中的隔膜属于?????????(填“阴”或“阳”)离子交换膜。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,写出该电池正负极电极反应:负极????,正极????。

参考答案:(1) ①如图(2分)
 本题解析:
本题解析:
试题分析:(1)如图所示。
(2)由装置图可知隔膜为阴离子交换膜;负极的电极反应式为:Al+4OH--3e-= AlO2-+2H2O
正极的电极反应式为:AgO+H2O+2e-= Ag+2OH-
本题难度:一般
4、选择题 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是(???)
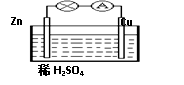
①Zn是负极?????????②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+?????④溶液中H+向Zn棒迁移
A.①②
B.①②③
C.②③④
D.①②③④
参考答案:B
本题解析:
试题分析::①Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,故①正确;
②Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,铜为正极,电子从负极流向正极,即由Zn经外电路流向Cu,故②正确;
③原电池的负极反应是负极金属失电子的氧化反应,即Zn-2e-═Zn2+,故③正确;
④H2+在溶液中移向正极,即由Zn棒向Cu棒迁移,故④错误.
故选B,
点评:本题考查学生原电池的工作原理,可以根据所学知识进行回答,难度不大。
本题难度:一般
5、选择题 一种新型的利用电化学反应原理来制备硫酸的方法已??经问世,其装置如图所示,电极为多孔的惰性电极,稀硫酸作电解质溶液,电池工作时,一极通入SO2气体,另一极通入O2.下列有关叙述正确的是( )
A.通入O2的电极为负极
B.正极反应式为:O2+4e-+2H2O=4OH-
C.电池工作时H+移向负极
D.负极反应式为:2SO2-4e-+4H2O=2SO42-+8H+
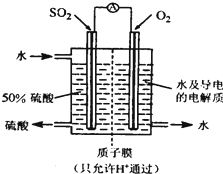
参考答案:A.通入氧气的电极上,氧气得电子发生还原反应,所以通入氧气的
本题解析:
本题难度:简单