微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA为阿伏伽德罗常数的值.下列叙述正确的是
A.常温常压下,46g的NO2和N2O4混合气体含有的分子数为NA
B.1mol Fe粉与1mol水蒸气充分反应转移的电子数为2NA
C.标准状况下,1L乙醇完全燃烧产生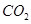 分子的数目为
分子的数目为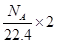
D.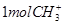 中含有电子数为
中含有电子数为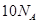
参考答案:B
本题解析:
试题分析:A、若气体全为NO2,分子数=46g÷46g/mol=1mol,若气体全为N2O4,分子数=46g÷92g/mol=0.5mol,所以46g的NO2和N2O4混合气体含有的分子数介于0.5NA ~ NA之间,错误;B、铁粉与水蒸气反应生成四氧化三铁和氢气,3Fe+4H2O  Fe3O4+4H2,
Fe3O4+4H2,
本题难度:一般
2、填空题 0.1molNH4+中约含有???????????个N,约含有????????????个H.
参考答案:6.02 × 1022???2.408 × 1023
本题解析:NH4+中含有1个氮原子,所以0.1molNH4+中含有0.1mol氮原子,个数约为0.1mol×6.02 × 1023 /mol=6.02 × 1022 。同理可得氢原子得个数是0.1mol×4×6.02 × 1023 /mol=2.408 × 1023。
本题难度:一般
3、选择题 下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:B
本题解析:
试题解析:根据1摩任何物质的质量都是以克为单位,数值上等于该种原子的相对原子质量;可知1molH2O的质量为18g,故A说法错误;3.01×1023个SO2分子即0.5molSO2的质量为0.5×64g=32g;故B说法正确;CH4的摩尔质量为16g/mol,故C说法错误;根据标准状况条件下1mol气体体积为22.4L;故D说法错误.
考点: 相对分子质量的概念及其计算;有关化学式的计算和推断
本题难度:一般
4、填空题 ( 30分 )(1)3.6克H2O的物质的量是????????,含有????????个H2O,含有???????molH.
(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ??,物质的量之比为 ?? ?,原子总数之比为 ?? ;质量之比为 ???。
(3)在标准状况下,22g CO2气体的体积是??????L ,与????????g N2含有相同的分子数。
(4)3.01×1023个OH—的物质的量为????????,质量为?????????,含有质子的物质的量为???????? ?,含有电子的物质的量为?????????,这些OH—与???????molNH3的质量相同,和????????g Na+含有的离子数相同。
?,含有电子的物质的量为?????????,这些OH—与???????molNH3的质量相同,和????????g Na+含有的离子数相同。
参考答案:(1)0.2mol, 0.2×6.02×1023, 0.4<
本题解析:略
本题难度:一般
5、选择题 密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直到沉淀完全为止,已知沉淀的质量与原硫酸溶液相等,则原硫酸溶液的浓度为??????????????????(???)
A.29.6%
B.42.1%
C.14.8mol/L
D.8mol/L
参考答案:B
本题解析:反应的化学方程式为:H2SO4 + BaCL2===== BaSO4 + 2H2O;设生成的硫酸钡为1mol;即原硫酸溶液的质量为233g,则原硫酸溶液的体积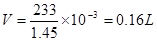 ,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为
,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为 本题难度:一般
本题难度:一般