微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH–,由此可知超临界水
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
参考答案:B
本题解析:
试题分析:超临界电离出较多的H+和OH–,其浓度大于常温下水中的H+和OH–,pH<7,但此时水中c(H+)和c(OH–)相等,故该水呈中性;利用“相似相溶原理”,结合题中“超临界水具有很强的溶解有机物的能力”可知超临界水表现出非极性溶剂的特性。
本题难度:一般
2、选择题 化学学习中,推理是一种重要的学习方法,下列推论正确的是(???)
A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B.由“某过程发生化学键断裂”,可推知该过程发生了化学变化
C.由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体
D.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱
参考答案:A
本题解析:
试题分析:等电子体具有相似的结构和物理性质,因为BF3 的正负电荷重合是非极性分子,所以由“BF3和SO3互为等电子体”,可推知二者均为非极性分子,A正确;化学变化必须是旧的化学键断裂新的化学键形成,因此仅有化学键断裂不能推出发生化学变化,B错误;MgCl2 是强酸弱碱盐,加热易水解产生挥发性的盐酸和Mg(OH)2,所以使得蒸干溶液得不到溶,而是Mg(OH)2 ,C错误;比较含氧酸盐的水解程度推得元素非金属性,必须比较最高价的含氧酸盐,所以D错误;故选A。
本题难度:一般
3、选择题 下列性质中,可以证明某化合物内一定存在离子键的是(??)
A.可溶于水
B.有较高的熔点
C.水溶液能导电
D.熔融状态能导电
参考答案:D
本题解析:
试题分析:只有离子化合物在熔融状态能导电。D正确。而可溶于水、有较高的熔点、水溶液能导电这样的性质,离子化合物,共价化合物都有。
本题难度:一般
4、选择题 下列说法中不正确的是[???? ]
A.双键、三键都是重键
B.成键原子间原子轨道重叠越多,共价键越牢固
C.因每一个原子未成对电子数是一定的,故配对原子个数也一定
D.每个原子轨道在空间都具有自己的方向性
参考答案:D
本题解析:
本题难度:简单
5、填空题 A、B、C、D、E为五种短周期元素,且原子序数依次增大。其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数。C原子的最外层中有两个不成对的电子。D、E的原子核内各自的质子数与中子数相等。C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素)。已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1。请回答下列问题:
(1)基态D原子的电子排布式为?????????,单质B2中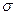 键与
键与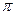 键的数目之比为
键的数目之比为
(2)化合物BH3(H代表氢元素)的立体构型为____,B原子的杂化轨道类型 是?????????。
(3)C和E的最简单氢化物分别为甲和乙,请比较相同条件下甲、乙的沸点大小,并说明理?????????。
(4)A可以形成多种结构不同的单质,其中M是所有已知晶体中硬度最大的,其晶体类型是?????????;若该晶体晶胞(如图所示)的边长为a cm,则其密度是?????????g·cm -3(只要求列式,不必计算出数值,阿伏加德罗常数为NA)。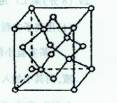
参考答案:
 本题解析:略
本题解析:略
本题难度:一般