微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验能获得成功的是
A.用溴水鉴别苯、乙醇、己烯、四氯化碳
B.加浓溴水,后过滤除去苯中少量苯酚
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离溴乙烷和甲苯
参考答案:A
本题解析:
试题分析:苯、四氯化碳和溴水发生萃取,有机层分别在上层和下层。乙醇和溴水互溶,己烯和溴水发生加成反应,A可以鉴别;B中生成的三溴苯酚能够溶解在苯中,并能除去,B错误;C不正确,应该用液溴;溴乙烷和甲苯互溶,并能直接分液,D不正确,答案选A。
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单
2、选择题 下列实验能获得成功的是
A.苯和浓溴水用铁做催化剂制溴苯
B.将苯与浓硝酸混合共热制硝基苯
C.甲烷与氯气光照制得纯净的一氯甲烷
D.乙烯通入溴的四氯化碳溶液得到1,2—二溴乙烷
参考答案:D
本题解析:略
本题难度:一般
3、实验题 (10分)配制500mL 0.5mol/L的NaOH溶液,试回答下列问题。
(1)需要NaOH固体的质量为?????????????。
(2)某同学用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将??????(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作应??????????????????????????????????????????????????????????????????????????。假定最终称得小烧杯的质量为????????(填“32.6g”或“32.61g”)。
(3)配制方法:设计了如下五个操作步骤,正确的顺序是???????????????。
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面距刻度线1c m~2cm。
m~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移 入容量
入容量 瓶。
瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是(???????)
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解用的烧杯未经多次洗涤
D.用胶头滴管加水定容时仰视刻度线
参考答案:(10分)
(1) 10.0g (2分)??
(
本题解析:略
本题难度:一般
4、实验题 实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率
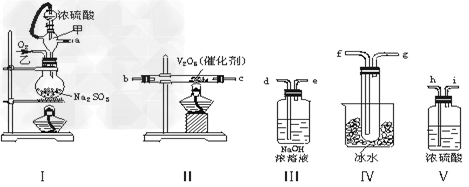
(1)这些装置的连接顺序(按气体左右的方向)是____→____→____→____→____→____→?____→?____→____(填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是________________?。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是____________。
(5)用n?mol?Na2SO3粉末与足量浓硫酸进行此实验, 当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m?g,则本实验中SO2的转化率为________。
参考答案:(1)a??h??i??b??c??f??g??d?
本题解析:
本题难度:一般
5、实验题 用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应:

C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6?+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:??????????????????????。
(2)冷凝管水的进口是????(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是?????????????????????。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由????变为?????。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为??????????????。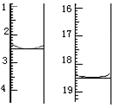
参考答案:(1) 三颈烧瓶…2分
(2) a …1分???硝酸…
本题解析:(1)三颈烧瓶;
(2)冷凝水上进下出,防止受热不均造成冷凝管炸裂;硝酸易挥发,冷凝回流;
(3)温度过高、硝酸浓度过大,导致H2C2O4进一步被氧化,3H2C2O4+2HNO3→6CO2+2NO↑+4H2O;
(4)实验室要注意三禁、八防,防污染,缺少尾气处理装置;
(5)起抽气作用,使吸滤瓶、安全瓶中的压强减小;
⑹滴定终点:溶液颜色有无色变成紫红色,且保持30s不变;KMnO4标准溶液体积16ml,物质的量n=16ml╳0.020 mol·L-1=0.32mmol;根据化学计量系数比,H2C2O4 的物质的量n=0.8mmol,二水合草酸的质量m=0.8mmol╳126g/mol=100.8mg,则该草酸晶体样品中二水合草酸的质量分数为0.1008g/0.12g=84.0%。
本题难度:一般