微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等量的小苏打用下列两种方法制取CO2:甲法——加热,乙法——跟足量的酸反应。两种方法得到的CO2气体的量的关系为(??? )
A.甲法多
B.乙法多
C.一样多
D.无法比较
参考答案:B
本题解析:由方程式比例关系知,加热法2 mol NaHCO3生成1 mol CO2,和酸反应1 mol生成1 mol CO2。
本题难度:一般
2、选择题 在KOH熔体中大气中的氧可将铬铁矿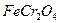 中Fe和
中Fe和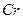 的氧化态都转化为+6氧化态,lmol
的氧化态都转化为+6氧化态,lmol 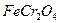 在理论上需要多少摩尔氧气使之氧化
在理论上需要多少摩尔氧气使之氧化
A.2mol
B.2.5mol
C.3mol
D.4mol
参考答案:B
本题解析:铬铁矿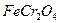 的Fe为+2价、Cr为+3价,都氧化成+6价,lmol共失去10mol电子,故需
的Fe为+2价、Cr为+3价,都氧化成+6价,lmol共失去10mol电子,故需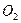 2.5mol。
2.5mol。
本题难度:一般
3、选择题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ
B.c(Fe2+)︰c(Cu2+) = 2︰1
C.c(Fe2+)︰c(Fe 3+) = 3︰1
D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L
参考答案:C
本题解析:
试题分析:这是Fe3+和Cu反应后的混合溶液根据2Fe3+ +Cu ===2Fe2+ +Cu2+的反应式,废液中Fe2+和Cu2+的浓度比必为2:1,生成8.61g AgCl沉淀,10mL溶液中有0.06molCl-;又已知10mL溶液可反应掉0.256g=0.004mol的Cu,可知10mL溶液中Fe3+=0.008mol,则这,10mL溶液中含有0.008molFeCl3,0.012molFe2+,0.06molCu2+可知答案C是错误的. 3+和金属单质的反应
本题难度:一般
4、选择题 将1.8g某金属与足量盐酸充分反应,产生2.24LH2(标准状况下),则该金属是( )
A.Al
B.Mg
C.Fe
D.Zn
参考答案:A
本题解析:
正确答案:A
金属的摩尔质量与化合价的比为1.8÷(2.24/22.4)×2=9,代入后四个选项分别是:27/3="9" 、 24/2=12、? 56/2="28" 、 65/2="32.5" ,A正确。
本题难度:一般
5、选择题 高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能净水的处理剂。工业制备高铁酸钾的离子反应方程式为:Fe(OH)3+ C1O—+ OH—→FeO42—+C1—+ H2O(未配平)
下列有关说法不正确的是(????)
A.由上述反应可知,Fe(OH)3的氧化性强于FeO42—
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3: 2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
参考答案:A
本题解析:A 错误,Fe(OH)3中铁是+3价,FeO42—中铁是+6价,所以,Fe(OH)3是还原剂,它的还原性强于FeO42—
B 正确。高铁酸钾中铁显+6价
C 正确,2Fe(OH)3+ 3C1O—+4 OH—=2FeO42—+3C1—+ 2H2O,故氧化剂和还原剂的物质的量之比为3: 2
D 正确,K2FeO4具有强的氧化性,能消毒杀菌,产物Fe(OH)3胶体,有吸附性,能吸附水中的悬浮杂质。
本题难度:一般