微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
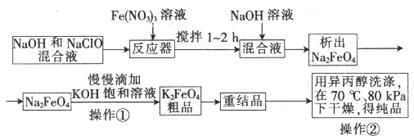
1、填空题 高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下:
试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为??????????????????????;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。
2、实验题
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH==?________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、淀粉-KI溶液、紫色石蕊试液。

3、简答题 硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等.某研究小组设计SnSO4制备路线如下:
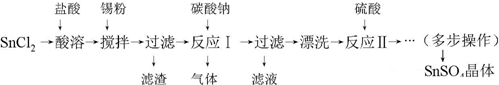
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡).请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因______.
(2)加入Sn粉的作用有两个:①调节溶液pH②______.
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO.该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全?______.
(4)多步操作包含的具体实验步骤的名称可以是:______.
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是______.
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):①将试样溶于盐酸中,发生的反应为:Sn+2HCl→SnCl2+H2↑②加入过量的FeCl3③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl→6FeCl3+2KCl+2CrCl3+7H2O取1.226g锡粉样品,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液32.00mL.则该锡粉样品中锡的质量分数是______.
4、选择题
A.直接观察焰色反应火焰为浅紫色,则一定不含Na元素
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色;铝热剂中一定不含Fe2O3
C.溶液中滴加盐酸酸化BaCl2溶液出现白色沉淀,则溶液中一定存在SO42—
D.某气体能使品红溶液褪色,则该气体为SO2气体
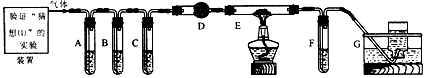
5、实验题 下面是某化学学习小组同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识

【提出猜想】(1)①______________________________;
②分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】(2)请设计完成“猜想②”的实验方案[用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂]。
(3)化学学习小组的同学继续利用图模1-5所示装置进行“猜想②”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
①证明分解产物中有CO2的现象是___________;证明分解产物中有CO的现象是____________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是___________________。
【交流讨论】(4)小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施______________________________________________________________。